填空题 较易0.85 引用1 组卷169
甲醇水蒸气重整制氢(SRM)系统可作为电动汽车燃料电池的理想氢源。系统中的两个反应如下:
主反应:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ΔH1>0
副反应:H2(g)+CO2(g)⇌CO(g)+H2O(g) ΔH2>0
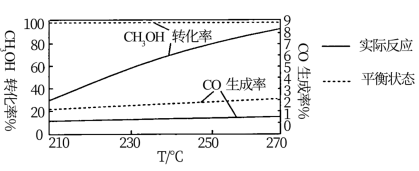
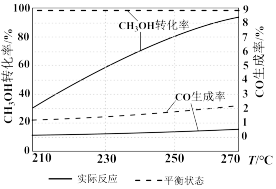
单位时间内,CH3OH转化率与CO生成率随温度的变化如图所示:
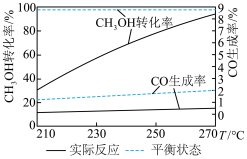
升温过程中CH3OH实际反应转化率不断接近平衡状态转化率的原因是_______ ;温度升高,CO实际反应生成率并没有不断接近平衡状态的生成率,其原因可能是_______
A.副反应逆向进行 B.部分CO转化为CH3OH
C.催化剂对副反应的选择性低 D.升温提高了副反应的焓变
主反应:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ΔH1>0
副反应:H2(g)+CO2(g)⇌CO(g)+H2O(g) ΔH2>0
单位时间内,CH3OH转化率与CO生成率随温度的变化如图所示:

升温过程中CH3OH实际反应转化率不断接近平衡状态转化率的原因是
A.副反应逆向进行 B.部分CO转化为CH3OH
C.催化剂对副反应的选择性低 D.升温提高了副反应的焓变
2024高三下·全国·专题练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
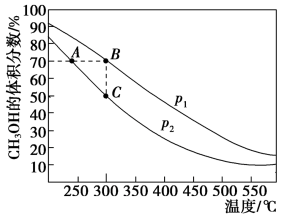
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol


