解答题-原理综合题 适中0.65 引用1 组卷27
甲烷和二氧化碳是两种主要的温室气体,工业上利用甲烷和二氧化碳催化重整为合成气,实现节能减排。重整过程中主要发生如下反应:
Ⅰ.
 ;
;
Ⅱ.
 。
。
回答下列问题:
(1)根据反应Ⅰ、Ⅱ,下列能提高 平衡转化率的是________(填字母)。
平衡转化率的是________(填字母)。
(2)研究表明,反应Ⅰ的一种反应机理(ads指吸附在催化剂表面的中间物种)如下:
ⅰ. ;
;
ⅱ. ;
;
ⅲ.……
ⅳ. ,
, 。
。
则反应ⅲ的方程式为________________ 。
(3)甲烷和二氧化碳催化重整反应体系中,催化剂失活主要是由于催化剂的表面积炭所致。催化剂表面积炭主要来自 裂解:
裂解:
 和
和 的歧化:
的歧化: 。
。
①歧化反应 的
的
________ 。
②研究表明,催化剂所用助剂碱性越强,抗积炭能力越强。用下列物质作助剂的催化剂抗积炭能力最强的是________ (填字母)。
A. B.
B. C.
C. D.
D.
(4)在恒压、反应物起始物质的量比 条件下,发生上述反应Ⅰ、Ⅱ,
条件下,发生上述反应Ⅰ、Ⅱ, 和
和 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。
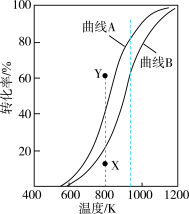
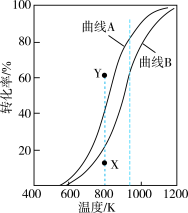
①表示 的平衡转化率随温度变化的曲线是
的平衡转化率随温度变化的曲线是________ (填“曲线A”或“曲线B”)。
②恒压、800K、初始 条件下,要使
条件下,要使 转化率的值从X点提高到Y点,需要改变的条件可能是
转化率的值从X点提高到Y点,需要改变的条件可能是________________ (答出1点即可)。
③已知图中940K时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中 的物质的量分数为
的物质的量分数为________________ ;此温度下,反应Ⅱ的平衡常数
________ 。
Ⅰ.
Ⅱ.
回答下列问题:
(1)根据反应Ⅰ、Ⅱ,下列能提高
| A.恒温恒容下增加 | B.恒温恒压下通入惰性气体 |
| C.升高温度 | D.加入更高效催化剂 |
(2)研究表明,反应Ⅰ的一种反应机理(ads指吸附在催化剂表面的中间物种)如下:
ⅰ.
ⅱ.
ⅲ.……
ⅳ.
则反应ⅲ的方程式为
(3)甲烷和二氧化碳催化重整反应体系中,催化剂失活主要是由于催化剂的表面积炭所致。催化剂表面积炭主要来自
①歧化反应
②研究表明,催化剂所用助剂碱性越强,抗积炭能力越强。用下列物质作助剂的催化剂抗积炭能力最强的是
A.
(4)在恒压、反应物起始物质的量比

①表示
②恒压、800K、初始
③已知图中940K时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中
23-24高二上·河南许昌·期末
类题推荐
以氢气、一氧化碳为主要组分的合成气是一种重要的化工原料,可以合成二甲醚、甲醇等许多重要的化工产品。回答下列问题:
(1)已知反应Ⅰ:
反应Ⅱ:
 液态水全部蒸发为气态水吸收
液态水全部蒸发为气态水吸收 的能量,则以气态
的能量,则以气态 和气态
和气态 为原料制备气态
为原料制备气态 和水蒸气的热化学方程式是
和水蒸气的热化学方程式是________________ .
(2)在一温度恒定的密闭容器中通入一定量的 和
和 ,在催化剂作用下转化为
,在催化剂作用下转化为 ,当
,当 与
与 的投料比为
的投料比为________ 时,混合气体 的体积分数最大;为了提高
的体积分数最大;为了提高 的平衡产率,不改变温度,可以采取的措施有
的平衡产率,不改变温度,可以采取的措施有________ 。(答出一条即可)
(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为 ,
, 分别为正逆反应速率常数,x为物质的量分数。
分别为正逆反应速率常数,x为物质的量分数。
①该反应在某条件下达到平衡后,升高温度,
________ (填“增大”或“减小”), 变化的程度
变化的程度________ (填“大于”“小于”或“等于”) 变化的程度。
变化的程度。
②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入 和
和 (代替合成气中的杂质,不参与反应),测得压强为
(代替合成气中的杂质,不参与反应),测得压强为 ,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如下:
,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如下:
则氢气的平衡转化率为________ ,该温度下的平衡常数 为
为________  (
( 为以分压表示的平衡常数,请用含
为以分压表示的平衡常数,请用含 的式子表示)。
的式子表示)。
(4)利用二氧化碳和甲烷经催化重整,可以制得合成气: ,按一定体积比加入甲烷和
,按一定体积比加入甲烷和 ,在恒容下发生反应,温度对
,在恒容下发生反应,温度对 和
和 产率的影响如图所示。则下列叙述正确的是________.
产率的影响如图所示。则下列叙述正确的是________.

(1)已知反应Ⅰ:
反应Ⅱ:
(2)在一温度恒定的密闭容器中通入一定量的
(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为
①该反应在某条件下达到平衡后,升高温度,
②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入
反应时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
容器体积/L | 4 | 3.5 | 3.2 | 3.0 | 2.9 | 2.8 | 2.8 |
(4)利用二氧化碳和甲烷经催化重整,可以制得合成气:

| A.该反应 |
| B.催化剂的使用可以降低反应的活化能,从而使平衡产率提高 |
| C.在恒压条件下进行该反应,产率将更高 |
| D.此反应的优选温度为 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网