解答题-原理综合题 适中0.65 引用1 组卷49
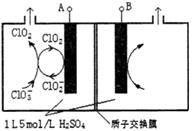
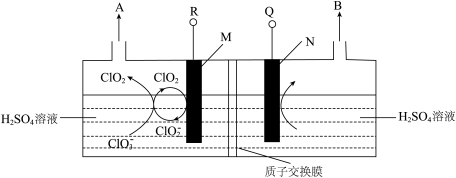
二氧化氯(ClO2)是高效、广谱、快速、安全的杀菌消毒剂,被认为是“第四代消毒剂”。电解法是目前最为热门的生产ClO2的方法之一。直接电解氯酸钠(NaClO3)溶液自动催化循环制备高纯ClO2的实验装置示意图如图所示。
回答下列问题(不考虑H+放电):
(1)亚氯酸根离子( )中氯元素的化合价为
)中氯元素的化合价为________ 价。NaClO3在水中的电离方程式为________________ 。
(2)已知铅酸蓄电池的工作原理为
①电解氯酸钠溶液时,M电极上发生________ (填“氧化”或“还原”)反应。
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与________ (填“Pb”或“PbO2”)电极相连,N电极上的电极反应式为________________ 。
(3)亚氯酸盐具有较强氧化性。可以用ClO2与H2O2和NaOH溶液反应制备NaClO2,制备时的化学方程式为________ 。反应每消耗2.24 L标准状况下的ClO2气体,可生成气体物质的质量为________ 。若要除去水中超标的亚氯酸盐,下列物质最适宜的是________ (填标号)。
A.明矾 B.氯化钾 C.盐酸 D.硫酸亚铁
(4)由图示信息等,可以判断下列说法错误的是________(填标号)。

回答下列问题(不考虑H+放电):
(1)亚氯酸根离子(
(2)已知铅酸蓄电池的工作原理为
①电解氯酸钠溶液时,M电极上发生
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与
(3)亚氯酸盐具有较强氧化性。可以用ClO2与H2O2和NaOH溶液反应制备NaClO2,制备时的化学方程式为
A.明矾 B.氯化钾 C.盐酸 D.硫酸亚铁
(4)由图示信息等,可以判断下列说法错误的是________(填标号)。
| A.氯酸钠与硫酸溶液反应可以产生ClO2 | B. |
| C.电解进行时,M极的电势高于N极 | D.电解时, |
23-24高二上·河南许昌·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网