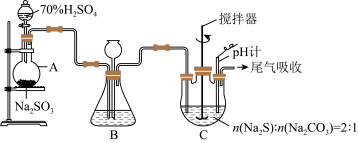解答题-实验探究题 适中0.65 引用1 组卷82
硫代硫酸钠(Na2S2O3)是硫酸钠中一个氧原子被硫原子取代的产物。硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g⋅mol−1)易溶于水,难溶于乙醇,在酸性环境中易分解。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1) 中心硫原子的杂化方式为
中心硫原子的杂化方式为___________ 。
(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是___________ 。
方法二:硫化碱法。装置如图所示。
(3)①仪器d的名称为___________ 。
②装置A中发生反应的化学方程式为___________ 。
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为___________ 。
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是_________ 。
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2 =2I−+
=2I−+ )
)
①步骤3中向碘量瓶中加入的指示剂是___________ 。
②由计算可得Na2S2O3·5H2O的纯度为___________ 。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1)
(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是
方法二:硫化碱法。装置如图所示。

(3)①仪器d的名称为
②装置A中发生反应的化学方程式为
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2
①步骤3中向碘量瓶中加入的指示剂是
②由计算可得Na2S2O3·5H2O的纯度为
23-24高三上·重庆·期中
类题推荐
硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1),已知它易溶于水,难溶于乙醇,在40~50℃熔化,48℃分解。某兴趣小组用两种方法制取硫代硫酸钠晶体并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是___________ 。
(2)下列说法不正确的是 ___________。
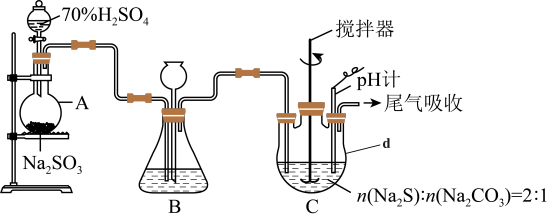
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称___________ 。
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为___________ 。
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 ___________ 。
(6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
①出“步骤2”中反应的离子方程式___________ 。
②试计算Na2S2O3·5H2O的纯度___________ 。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是
(2)下列说法不正确的是 ___________。
| A.蒸发浓缩至溶液表面出现大量沉淀时,停止加热 |
| B.快速冷却,可析出较大晶体颗粒 |
| C.冷却结晶后的固液混合物中加入乙醇可提高产率 |
| D.反应后趁热过滤是除去硫等不溶物 |
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O
(6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O
①出“步骤2”中反应的离子方程式
②试计算Na2S2O3·5H2O的纯度
硫代硫酸钠晶体(Na2S2O3•5H2O,248 g•mol-1)可用于氰化物及腈类中毒及各种砷、碘、汞、铅中毒治疗,已知它易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在40~50℃熔化,48℃分解。某兴趣小组用两种方法制取硫代硫酸钠晶体并加以应有。
I.制备Na2S2O3•5H2O
方法一:亚硫酸钠法.
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的疏粉,加入少量乙醇充分搅拌均匀后,加到上述溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是____ 。
(2)下列说法不正确的是____ 。
方法二:硫化碱法,装置如图。
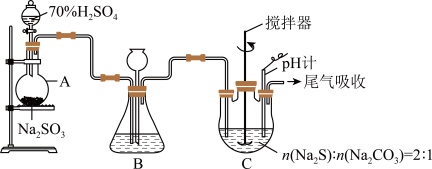
(3)装置C中,将Na2S和Na2CO3以2∶1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为____ 。
(4)三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的是____ 。
II.Na2S2O3的应用
(5)Na2S2O3解毒氟化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入____ 。
(6)设计以下实验测定粗产品中Na2S2O3•5H2O的含量:
步骤1:准确称取8.00 g样品,溶于水,加入5 mL甲醛,配成100 mL溶液。
步骤2:准确称取0.294 g K2Cr2O7于碘量瓶中,加入20 mL蒸馏水溶解,再加入5 mL1 mol·L-1 H2SO4和20 mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100 mL。
步骤3:向碘量瓶中加入1 mL1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00 mL。(已知:I2+2 =2I-+
=2I-+ )
)
①写出“步骤2”中反应的离子方程式____ 。
②试计算Na2S2O3•5H2O的纯度____ 。
I.制备Na2S2O3•5H2O
方法一:亚硫酸钠法.
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的疏粉,加入少量乙醇充分搅拌均匀后,加到上述溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是
(2)下列说法不正确的是
| A.蒸发浓缩至溶液表面出现大量沉淀时,停止加热 |
| B.快速冷却,可析出较大晶体颗粒 |
| C.冷却结晶后的固液混合物中加入乙醇可提高产率 |
| D.减压过滤的主要仪器为布氏漏斗、抽滤瓶、安全瓶、抽气泵 |
方法二:硫化碱法,装置如图。

(3)装置C中,将Na2S和Na2CO3以2∶1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为
(4)三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的是
II.Na2S2O3的应用
(5)Na2S2O3解毒氟化物原理:S2O
(6)设计以下实验测定粗产品中Na2S2O3•5H2O的含量:
步骤1:准确称取8.00 g样品,溶于水,加入5 mL甲醛,配成100 mL溶液。
步骤2:准确称取0.294 g K2Cr2O7于碘量瓶中,加入20 mL蒸馏水溶解,再加入5 mL1 mol·L-1 H2SO4和20 mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100 mL。
步骤3:向碘量瓶中加入1 mL1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00 mL。(已知:I2+2
①写出“步骤2”中反应的离子方程式
②试计算Na2S2O3•5H2O的纯度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网