填空题 适中0.65 引用1 组卷71
人们日常生产生活与化学有着紧密的联系。
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
①常温下, 溶液加水稀释,下列数值一定变小的是
溶液加水稀释,下列数值一定变小的是___________ (填字母)。
A.c(H+) B. C.
C. D.
D.
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将___________ (填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)___________ (乙)(填“>”“<”或“=”)。
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示:
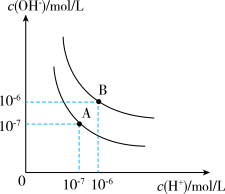
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为___________ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________ 。
②同浓度的CH3COO-、 、
、 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为___________ 。
③将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:___________ 。
④将SO2通入该氨水中,当c(OH-)降至 时,溶液中的
时,溶液中的
___________ 。
⑤下列微粒在溶液中不能大量共存的是___________ 。
A. 、
、 B.ClO-、
B.ClO-、 C.
C. 、
、 D.HClO、
D.HClO、
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
①常温下,
A.c(H+) B.
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示:

25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | 电离常数(Ka) | |
| NH3·H2O | Kb=1.8×10-5 | |
| HClO | Kₐ=4.7×10-8 | |
| H2CO3 | Ka1=4.2×10-7 | Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.54×10-2 | Ka2=1.02×10-7 |
| CH3COOH | Kₐ=1.7×10-5 | |
②同浓度的CH3COO-、
③将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:
④将SO2通入该氨水中,当c(OH-)降至
⑤下列微粒在溶液中不能大量共存的是
A.
23-24高一上·四川眉山·期末
类题推荐
(1)常温下0.1mol·L-1的盐酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者_____ (填“>”“<”或“=”)。
II.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(2)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
(3)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________ (填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中 的比值将
的比值将________ (填“增大”“减小”或“无法确定”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)__ V(乙) (填“>”“<”或“=”)。
(5)已知25℃时,下列酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是________,写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________。
Ⅲ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
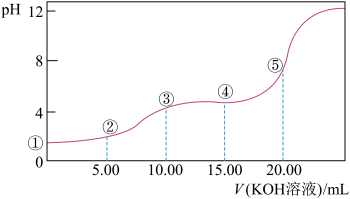
(6)点③所示溶液中所有离子的浓度由大到小的顺序为:_____________________ 。
(7)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O )+c(C2O
)+c(C2O )=
)=________ mol/L。
(1)常温下0.1mol·L-1的盐酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者
II.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(2)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
| A.c(H+) | B. | C.c(H+)c(OH—) | D. |
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)
(5)已知25℃时,下列酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________,写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________。
| A.HCO | B.CO | C.ClO- | D.CH3COO- |
Ⅲ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

(6)点③所示溶液中所有离子的浓度由大到小的顺序为:
(7)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O
Ⅰ.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____ 。
A.c(H+) B. C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________ (填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中 的比值将
的比值将________ (填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)________ (填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是________ 。
A.HCO B.CO
B.CO C.ClO- D.CH3COO-
C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________
Ⅱ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
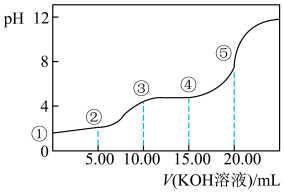
(5)点③所示溶液中所有离子的浓度由大到小的顺序为:________________________ 。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4−)+c(C2O42−)=________ mol/L。
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.
 C.c(H+)·c(OH-)
C.c(H+)·c(OH-) (2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡
 的比值将
的比值将(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)
(4)已知25℃时,下列酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是
A.HCO
 B.CO
B.CO C.ClO- D.CH3COO-
C.ClO- D.CH3COO-写出下列反应的离子方程式:HClO+Na2CO3(少量):
Ⅱ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

(5)点③所示溶液中所有离子的浓度由大到小的顺序为:
现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____ 。
A.c(H+) B. c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________ (填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中的 c(H+)/c(CH3COOH) 比值将________ (填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)______ (填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
①下列微粒可以大量共存的是______  填字母
填字母 。
。
a.CO32-、HSO3- b.HCO3-、HSO3-
c.SO32-、HCO3- d.CO32- 、H2CO3
②写出下列反应的离子方程式:
H2SO3+Na2CO3(少量):_______________
室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
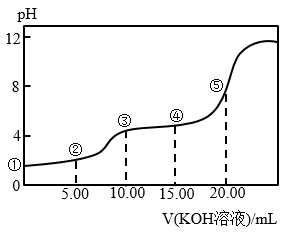
(5)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4−)+c(C2O42−)=_____ mol/L。点⑤所示的溶液中各离子浓度的大小顺序_____ .
(6)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于锥形瓶中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是_______ ;该过程中发生反应的离子方程式为________ ;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为________ 。
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B. c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)
(4)已知25℃时,下列酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 | K1=1.54×10-2 K2=1.02×10-7 |
a.CO32-、HSO3- b.HCO3-、HSO3-
c.SO32-、HCO3- d.CO32- 、H2CO3
②写出下列反应的离子方程式:
H2SO3+Na2CO3(少量):
室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

(5)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4−)+c(C2O42−)=
(6)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于锥形瓶中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


