解答题-实验探究题 适中0.65 引用1 组卷235
I.五氧化二氮( )是一种绿色硝化剂,在军用炸药、火箭推进剂、医药等工业中得到广泛应用。常温下
)是一种绿色硝化剂,在军用炸药、火箭推进剂、医药等工业中得到广泛应用。常温下 为白色固体,可溶于二氯甲烷(
为白色固体,可溶于二氯甲烷( )等有机溶剂,微溶于水且与水反应生成硝酸,高于室温时不稳定。
)等有机溶剂,微溶于水且与水反应生成硝酸,高于室温时不稳定。
(1)1840年,Devill将干燥的氯气通入无水硝酸银中,首次制得了固体 。该反应的氧化产物为空气中的主要成分之一,写出反应的化学方程式:
。该反应的氧化产物为空气中的主要成分之一,写出反应的化学方程式:___________ 。
Ⅱ.某化学兴趣小组设计用臭氧( )氧化法制备
)氧化法制备 ,反应原理为
,反应原理为 。(已知常温常压下
。(已知常温常压下 )
)
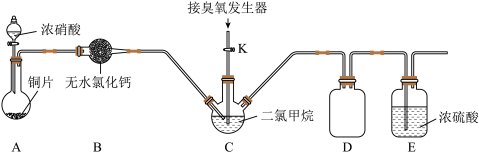
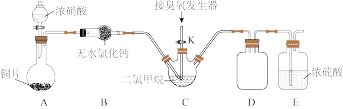
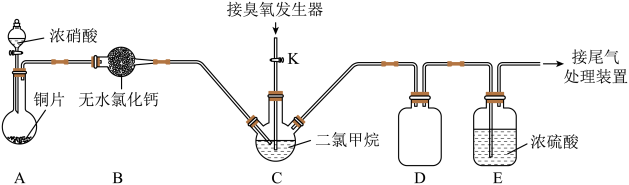
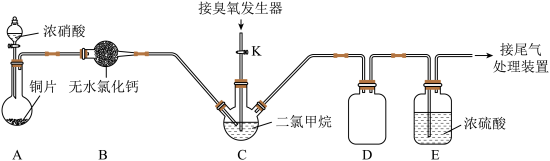
(2)装置D的作用是___________ ;装置E的作用是___________ 。
(3)实验时,先将三口烧瓶C浸入___________ (填字母编号)中,打开装置A中分液漏斗的活塞,随即关闭。一段时间后C中液体变为红棕色。然后打开活塞K,通过臭氧发生器向三口烧瓶中通入含有臭氧的氧气。
a.热水 b.冰水 c.自来水 d.饱和食盐水
(4)C中二氯甲烷( )的作用是
)的作用是___________ 。
(5)判断C中反应已结束的简单方法是___________ 。
(6)该装置存在一处明显缺陷,请指出___________ 。
(1)1840年,Devill将干燥的氯气通入无水硝酸银中,首次制得了固体
Ⅱ.某化学兴趣小组设计用臭氧(

(2)装置D的作用是
(3)实验时,先将三口烧瓶C浸入
a.热水 b.冰水 c.自来水 d.饱和食盐水
(4)C中二氯甲烷(
(5)判断C中反应已结束的简单方法是
(6)该装置存在一处明显缺陷,请指出
23-24高一上·上海·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网