填空题 较易0.85 引用2 组卷111
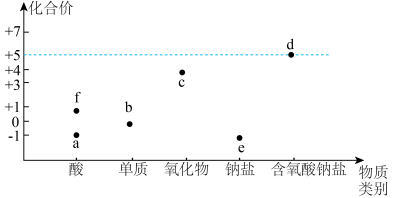
如图是氯的价类二维图:
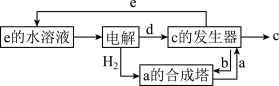
其中c是一种新型净水剂,其合成路线如图:
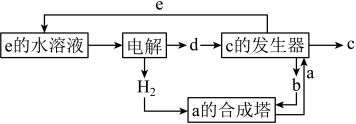
(1)c为___________ (填化学式)。
(2)“a时合成塔”中发生反应的化学方程式为___________ 。
(3)“c的发生器”中发生反应的离子方程式为___________ (写出正确的离子方程式并用单线桥 法分析电子转移的情况)。
(4)实验测得等物质的量的f、 、
、 具有相同的漂白能力,原因是
具有相同的漂白能力,原因是___________ 。
(5)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如: 的氧化半反应可以表示为:
的氧化半反应可以表示为: ,电解时生成d的氧化半反应式为
,电解时生成d的氧化半反应式为___________ 。
(6)为测定新型净水剂溶液中c的浓度(加入某种物质使c在溶液中稳定存在),量取 该溶液于锥形瓶中,加蒸馏水稀释到
该溶液于锥形瓶中,加蒸馏水稀释到 ,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应:
,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应: )。然后用
)。然后用 硫代硫酸钠溶液还原产生的
硫代硫酸钠溶液还原产生的 (发生反应:
(发生反应: ),完全反应时消耗的硫代硫酸钠的体积
),完全反应时消耗的硫代硫酸钠的体积 ,计算此新型净水剂中c的物质的量浓度为
,计算此新型净水剂中c的物质的量浓度为___________ 。

其中c是一种新型净水剂,其合成路线如图:

(1)c为
(2)“a时合成塔”中发生反应的化学方程式为
(3)“c的发生器”中发生反应的离子方程式为
(4)实验测得等物质的量的f、
(5)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:
(6)为测定新型净水剂溶液中c的浓度(加入某种物质使c在溶液中稳定存在),量取
23-24高一上·吉林长春·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网