解答题-原理综合题 适中0.65 引用1 组卷84
工业上通过 与
与 共转化生成合成气,助力实现“碳达峰”。
共转化生成合成气,助力实现“碳达峰”。
其主反应ⅰ
 ;
;
副反应主要有:ⅱ
 ;
;
ⅲ
 (积碳反应);
(积碳反应);
ⅳ
 (积碳反应);
(积碳反应);
ⅴ
 (积碳反应)
(积碳反应)
Ⅰ.若只考虑主反应
(1)
___________ 。
(2)该反应在一定条件下建立平衡后,下列说法正确的是___________。
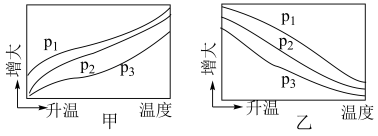
(3)不同压强下,按照 投料,实验测得
投料,实验测得 平衡转化率和
平衡转化率和 平衡产率随温度变化关系如下图所示,纵坐标可表示
平衡产率随温度变化关系如下图所示,纵坐标可表示 平衡转化率的为
平衡转化率的为___________ (填“甲”或“乙”),压强由大到小的顺序为___________ 。
(4)一定条件下,向真空密闭容器中通入 和
和 ,使总压为
,使总压为 。反应达到平衡时,容器中气体压强为原来的
。反应达到平衡时,容器中气体压强为原来的 倍。已知容器中气体的分压
倍。已知容器中气体的分压 ,用气体的分压计算得到的平衡常数称为分压平衡常数
,用气体的分压计算得到的平衡常数称为分压平衡常数 。则该反应的平衡常数
。则该反应的平衡常数 为
为___________  。
。
Ⅱ.若考虑副反应
在 、CH4和
、CH4和 总物质的量为
总物质的量为 的条件下,温度及投料比[
的条件下,温度及投料比[ ]对或
]对或 平衡转化率的影响如图所示。
平衡转化率的影响如图所示。
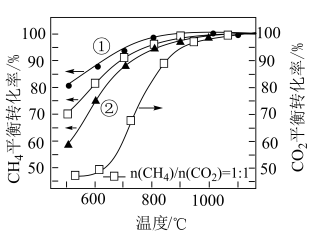
(5)根据 的曲线,推断表示
的曲线,推断表示 的
的 平衡转化率的曲线是
平衡转化率的曲线是___________ (填“①”或“②”)。
(6)在投料比 下
下 平衡转化率
平衡转化率 明显大于
明显大于 的原因为
的原因为___________ 。
(7)为了提高合成气的产量和消除积碳,可以往反应体系中加入适量的___________ 。
其主反应ⅰ
副反应主要有:ⅱ
ⅲ
ⅳ
ⅴ
Ⅰ.若只考虑主反应
(1)
(2)该反应在一定条件下建立平衡后,下列说法正确的是___________。
| A.升高温度,反应平衡常数增大 |
| B.增大压强有利于反应平衡正向移动 |
| C.增大 |
| D.增大 |
(3)不同压强下,按照

(4)一定条件下,向真空密闭容器中通入
Ⅱ.若考虑副反应
在

(5)根据
(6)在投料比
(7)为了提高合成气的产量和消除积碳,可以往反应体系中加入适量的
23-24高二上·福建南平·期末
类题推荐
工业上通过CO2与CH4共转化生成合成气,助力实现“碳达峰”。其主反应为:
i.
 H1=+247kJ·mol-1
H1=+247kJ·mol-1
副反应主要有:
ii.
 H2=+41kJ·mol-1
H2=+41kJ·mol-1
iii.
 H3=+75kJ·mol-1(积碳反应)
H3=+75kJ·mol-1(积碳反应)
iv.
 H4=___________kJmol-1(积碳反应)
H4=___________kJmol-1(积碳反应)
v.
 H5=-131.4kJ·mol‑1(积碳反应)
H5=-131.4kJ·mol‑1(积碳反应)
回答下列问题:
(1)由反应v和反应ii可得反应iv的 H4=
H4=___________ kJ·mol-1。
I.若只考虑主反应。
(2)下列有关主反应的说正确的是___________(填字母)。
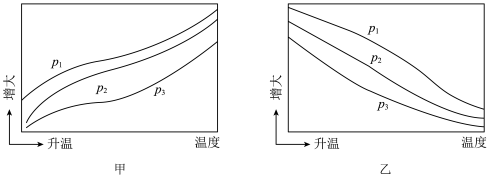
(3)不同压强下,按照n(CH4):n(CO2)=1:1投料,实验测得CO2平衡转化率和CO平衡产率随温度变化关系如下图所示,纵坐标可表示CO2平衡转化率的为___________ (填“甲”或“乙”),压强由小到大的顺序为___________ 。___________ (MPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。计算结果用分数形式表示)。
II.若考虑副反应。
在100kPa、CH4和CO2总物质的量为2mol的条件下,温度及投料比[n(CH4)/n(CO2)]对CH4或CO2平衡转化率的影响如图所示。___________ (填“①”或“②”)。
(6)在投料比n(CH4)/n(CO2)=1:1时,CO2平衡转化率在850℃条件下明显大于在600℃条件下的原因为___________ 。
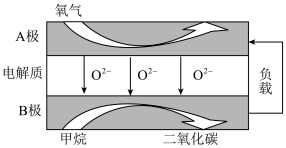
(7)以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。___________ 。
i.
副反应主要有:
ii.
iii.
iv.
v.
回答下列问题:
(1)由反应v和反应ii可得反应iv的
I.若只考虑主反应。
(2)下列有关主反应的说正确的是___________(填字母)。
| A.加入催化剂,能增大反应活化能,加快化学反应速率 |
| B.减小压强有利于平衡正向移动 |
| C.增大CH4浓度,可以提高CO2的平衡转化率 |
| D.升高温度,该反应的平衡常数减小 |
(3)不同压强下,按照n(CH4):n(CO2)=1:1投料,实验测得CO2平衡转化率和CO平衡产率随温度变化关系如下图所示,纵坐标可表示CO2平衡转化率的为
II.若考虑副反应。
在100kPa、CH4和CO2总物质的量为2mol的条件下,温度及投料比[n(CH4)/n(CO2)]对CH4或CO2平衡转化率的影响如图所示。
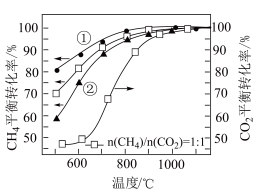
(6)在投料比n(CH4)/n(CO2)=1:1时,CO2平衡转化率在850℃条件下明显大于在600℃条件下的原因为
(7)以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。
我国力争2060年前实现碳中和。CH4与CO2催化重整是实现碳中和的热点研究课题。该催化重整反应体系主要涉及以下反应:
反应I:主反应CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1 Kp1
2CO(g)+2H2(g) ΔH1 Kp1
反应II:副反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH2 Kp2
CO(g)+H2O(g) ΔH2 Kp2
反应III:积碳反应2CO(g) CO2(g)+C(s) ΔH3 Kp3
CO2(g)+C(s) ΔH3 Kp3
反应IV:积碳反应CH4(g) C(s)+2H2(g) ΔH4 Kp4
C(s)+2H2(g) ΔH4 Kp4
(1)已知H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0lkJ·mol-1,H2O(l)= H2O(g) ΔH5=+44kJ·mol-1,则反应II的ΔH2=____ kJ·mol-1。
(2)设Kp为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应III、IV的lgKp随 (T表示温度)的变化如图所示。据图判断,反应I的ΔH1
(T表示温度)的变化如图所示。据图判断,反应I的ΔH1_____ 0(选填“大于”、“小于”或“等于”),说明判断的理由____ 。____ 。
(4)在一定条件下的密闭容器中,按照 =1加入反应物,发生反应I(反应II、III、IV可忽略)。在不同条件下达到平衡,设体系中平衡状态下甲烷的物质的量分数为x(CH4),在T=800℃下的x(CH4)随压强P的变化曲线、在P=100kPa下的x(CH4)随温度T的变化曲线如图所示。
=1加入反应物,发生反应I(反应II、III、IV可忽略)。在不同条件下达到平衡,设体系中平衡状态下甲烷的物质的量分数为x(CH4),在T=800℃下的x(CH4)随压强P的变化曲线、在P=100kPa下的x(CH4)随温度T的变化曲线如图所示。____ ,判断的理由是____ 。
②若x(CH4)=0.1.则CO2的平衡转化率为____ 。
反应I:主反应CH4(g)+CO2(g)
反应II:副反应CO2(g)+H2(g)
反应III:积碳反应2CO(g)
反应IV:积碳反应CH4(g)
(1)已知H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0lkJ·mol-1,H2O(l)= H2O(g) ΔH5=+44kJ·mol-1,则反应II的ΔH2=
(2)设Kp为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应III、IV的lgKp随

| A.在投料时适当增大 |
| B.在一定条件下建立平衡后,移去部分积碳,反应III和反应IV平衡均向右移 |
| C.随着投料比 |
| D.降低反应温度,反应I、II、IV的正反应速率减小,逆反应速率增大;反应III的正反应速率增大,逆反应速率减小 |

②若x(CH4)=0.1.则CO2的平衡转化率为
氨催化氧化是硝酸工业的基础,氨气在 催化剂作用下发生主反应Ⅰ和副反应Ⅱ
催化剂作用下发生主反应Ⅰ和副反应Ⅱ
Ⅰ.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H1=-905 kJ•mol-1
4NO(g)+6H2O(g)△H1=-905 kJ•mol-1
Ⅱ.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H2
2N2(g)+6H2O(g) △H2
(1)已知:
则△H2=___________ 。
(2)以 为催化剂,在
为催化剂,在 密闭容器中充入
密闭容器中充入 和
和 ,测得有关物质的量与温度的关系如图甲所示。
,测得有关物质的量与温度的关系如图甲所示。
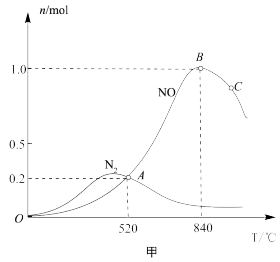
① 该催化剂在高温时对反应
该催化剂在高温时对反应___________ 更有利(填“Ⅰ”或“Ⅱ”)。
② 时,
时, 的转化率为
的转化率为______ 。
③ 时,反应 Ⅱ的平衡常数
时,反应 Ⅱ的平衡常数
_____ (列出计算式即可)。
④下列说法正确的是___________ (填序号)。
A.工业上氨催化氧化生成 时,最佳温度应控制在
时,最佳温度应控制在 左右
左右
B.增大 和
和 的初始投料比可以提高
的初始投料比可以提高 生成
生成 的平衡转化率
的平衡转化率
C.投料比不变,增加反应物的浓度可以提高 生成
生成 的平衡转化率
的平衡转化率
D.使用催化剂时,可降低反应的活化能,加快其反应速率
(3)在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 。反应原理为
。反应原理为
①将一定比例的 、
、 与
与 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器(如图乙所示)中发生上述反应,反应相同时间
的反应器(如图乙所示)中发生上述反应,反应相同时间 的去除率随反应温度的变化曲线如图丙所示。
的去除率随反应温度的变化曲线如图丙所示。
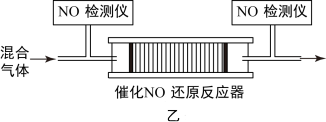
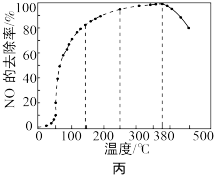
当反应温度高于 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是___________ (填序号)。
A. 百分含量减小 B.副反应增多 C.催化剂活性降低 D.反应活化能增大
百分含量减小 B.副反应增多 C.催化剂活性降低 D.反应活化能增大
②已知:上述反应的平衡常数与温度的关系为 。若该反应在某温度下达到平衡,升高温度时,平衡
。若该反应在某温度下达到平衡,升高温度时,平衡___________ (填“正向”“逆向”或“不”)移动,原因是___________  逆反应速率将
逆反应速率将___________ (填“增大”“减小”或“不变”)
Ⅰ.4NH3(g)+5O2(g)
Ⅱ.4NH3(g)+3O2(g)
(1)已知:
| 断裂 | |||
则△H2=
(2)以

①
②
③
④下列说法正确的是
A.工业上氨催化氧化生成
B.增大
C.投料比不变,增加反应物的浓度可以提高
D.使用催化剂时,可降低反应的活化能,加快其反应速率
(3)在有氧条件下,新型催化剂
①将一定比例的
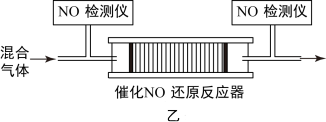

当反应温度高于
A.
②已知:上述反应的平衡常数与温度的关系为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


