解答题-原理综合题 适中0.65 引用1 组卷113
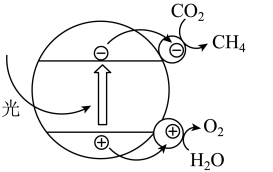
空间站内搭载萨巴蒂尔装置将 转化为
转化为 ,再通过电解水装置回收氧元素.其系统原理如图:
,再通过电解水装置回收氧元素.其系统原理如图:
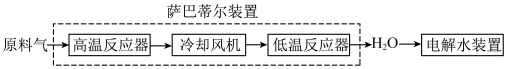
萨巴蒂尔装置内发生反应为
反应Ⅰ:
反应Ⅱ:
(1)已知 ,则
,则
_________ .
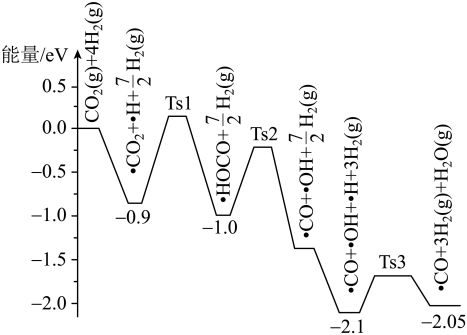
(2)在“高温反应器”中以 为催化剂,一段时间内不同温度
为催化剂,一段时间内不同温度 转化率如图.已知反应Ⅰ的速率方程:
转化率如图.已知反应Ⅰ的速率方程: ,
, .
.
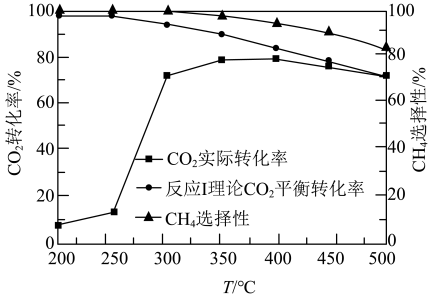
①250℃前, 实际转化率随温度变化不大的主要原因是
实际转化率随温度变化不大的主要原因是___________ .
②300℃时
__________  (填“>”“<”或“=”).
(填“>”“<”或“=”).
③达到平衡后,升高温度, 增大的倍数
增大的倍数_________  增大的倍数(填“>”“<”或“=”).
增大的倍数(填“>”“<”或“=”).
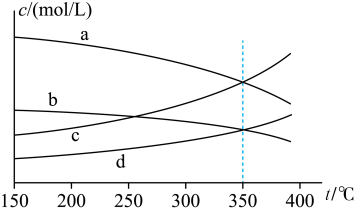
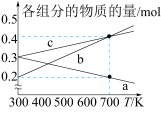
(3)在“低温反应器”中达平衡时,各组分物质的量分数随温度变化如图.已知原料气中含有 及
及 .
.
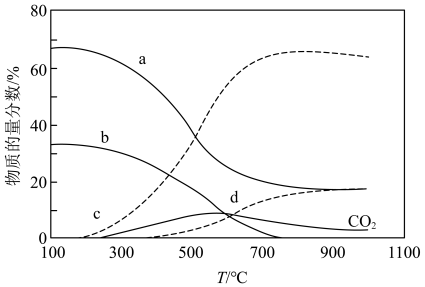
① 物质的量分数随温度变化的曲线为
物质的量分数随温度变化的曲线为____________ (填标号).
②300~500℃, 物质的量分数随温度升高而上升的原因是
物质的量分数随温度升高而上升的原因是___________ .
③某温度下达平衡时,总压为 ,剩余
,剩余 和
和 ,则反应Ⅰ的
,则反应Ⅰ的 为
为___________ (列出计算式, 为以分压表示的平衡常数,分压=总压×物质的量分数);
为以分压表示的平衡常数,分压=总压×物质的量分数);
此时氧元素的回收率为____________ [回收率 ].
].
(4)从平衡与速率角度分析萨巴蒂尔装置采用高温和低温反应器串联的优点是___________ .

萨巴蒂尔装置内发生反应为
反应Ⅰ:
反应Ⅱ:
(1)已知
(2)在“高温反应器”中以

①250℃前,
②300℃时
③达到平衡后,升高温度,
(3)在“低温反应器”中达平衡时,各组分物质的量分数随温度变化如图.已知原料气中含有

①
②300~500℃,
③某温度下达平衡时,总压为
此时氧元素的回收率为
(4)从平衡与速率角度分析萨巴蒂尔装置采用高温和低温反应器串联的优点是
23-24高二上·福建厦门·期末
类题推荐
为了实现“碳达峰、碳中和”的目标,可以用 为碳源制取多种化学物质。
为碳源制取多种化学物质。
(1) 与
与 在固载金属催化剂(M)上可发生反应生成HCHO(g)和
在固载金属催化剂(M)上可发生反应生成HCHO(g)和 ,已知298K时下列几种物质的标准生成焓[在标态和T(K)条件下由指定单质生成1mol某种物质的焓变]。
,已知298K时下列几种物质的标准生成焓[在标态和T(K)条件下由指定单质生成1mol某种物质的焓变]。
则反应 的
的
________ 。
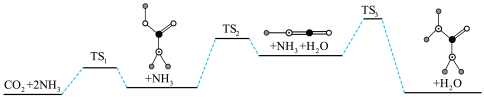
(2) 与
与 合成尿素的反应为
合成尿素的反应为 ,下图是合成尿素的历程及能量变化,TS表示过渡态。
,下图是合成尿素的历程及能量变化,TS表示过渡态。________ 个基元反应,其中起决速步骤的方程式是________ 。
(3)以 、
、 为原料合成
为原料合成 的主要反应如下:
的主要反应如下:
Ⅰ.

Ⅱ.

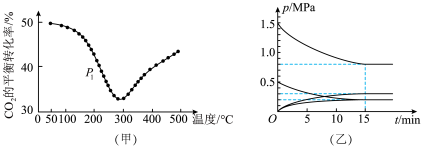
①不同条件下,按照 投料,同时发生反应Ⅰ和反应Ⅱ,
投料,同时发生反应Ⅰ和反应Ⅱ, 的平衡转化率如图甲所示。
的平衡转化率如图甲所示。________ (填“正向”、“逆向”或“不”)移动;压强为 时,温度高于300℃后,
时,温度高于300℃后, 的平衡转化率随温度升高而增大的主要原因是
的平衡转化率随温度升高而增大的主要原因是________ 。
②在温度为T℃下,将 和
和 充入容积为VL的恒容密闭容器中。同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图乙所示。图中缺少了一种组分的分压变化,该组分是
充入容积为VL的恒容密闭容器中。同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图乙所示。图中缺少了一种组分的分压变化,该组分是________ (填化学式)。T℃时,反应Ⅰ的平衡常数
________  (用分压代替浓度,计算结果保留两位有效数字)。
(用分压代替浓度,计算结果保留两位有效数字)。
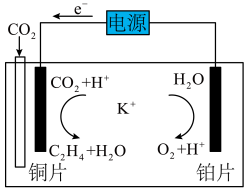
(4)利用一种钾盐的酸性溶液作电解质, 电催化还原为乙烯,如下图所示,写出阴极上的电极反应式:
电催化还原为乙烯,如下图所示,写出阴极上的电极反应式:________ 。
(1)
物质 | HCHO(g) | |||
标准生成焓 | -393.5 | -242 | -115.9 | 0 |
(2)
(3)以
Ⅰ.
Ⅱ.
①不同条件下,按照
②在温度为T℃下,将
(4)利用一种钾盐的酸性溶液作电解质,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网