解答题-原理综合题 适中0.65 引用1 组卷88
Ⅰ.完成下列问题
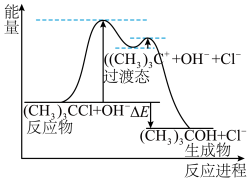
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______
(2)下列有关热化学方程式的叙述正确的是_______
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应___________ (填“能”或“不能”)用于消除汽车尾气中的NO,理由为___________ 。实际上,如果不采取一定措施,汽车尾气并不会自动消除,原因是___________ ;
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g) 2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
主要副反应有:Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
Ⅲ.CH4(g) C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
Ⅳ.CO(g)+H2(g) C(s)+H2O(g),ΔH4=-131kJ·mol-1
C(s)+H2O(g),ΔH4=-131kJ·mol-1
完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式___________ 。
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是___________ 、___________ (任写两条)。
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:___________ 。
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。___________ 。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
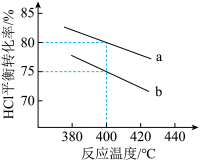
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=___________ 。
②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数___________ 点对应的平衡常数最小,理由是:___________ ;___________ 点对应压强最大,理由是:___________ 。
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______

| A.该反应为吸热反应 |
| B.(CH3)3C+比(CH3)3CCl稳定 |
| C.第一步反应一定比第二步反应快 |
| D.增大碱的浓度和升高温度均可加快反应速率 |
(2)下列有关热化学方程式的叙述正确的是_______
| A.已知C(石墨,s) |
| B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ·mol-1 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| D.N2(g)+3H2(g) |
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g)
主要副反应有:Ⅱ.CO2(g)+H2(g)
Ⅲ.CH4(g)
Ⅳ.CO(g)+H2(g)
完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=

②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数
23-24高二上·上海·期末
类题推荐
氮的氧化物是主要的空气污染物,目前消除氯氧化物污染的方法有多种。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:________
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=___ mol,NO2的转化率a1=_________ .其它条件不变,反应在恒压条件下进行,平衡时NO2的转化率a2____ a1(填“大于” 小于”或“ 等于” )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据 是_________
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为_______ (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是________ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g) N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
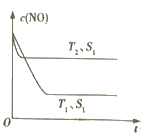
①该反应的ΔH____ 0(填“>”或“<”)。
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。____
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下| 时间 浓度(mol/L) 物质 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据 是
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的ΔH
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
“绿水青山就是金山银山”,因此如何消除大气污染物中的NOx、SO2等气体成为人们关注的主要问题之一。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1= a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2= b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3= c kJ/mol。
则反应2SO2(g)+ 4NH3·H2O(aq)+ O2(g) = 2(NH4)2SO4(aq)+ 2H2O(l)的ΔH=______ kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH=−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~20 min内,平均反应速率v(SO2)=_____ mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____ (填字母)。
A.通入一定量的O2B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积D.加入高效的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。
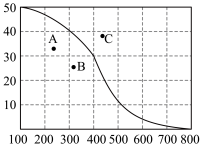
①已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________________________________ ;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×105Pa时,该反应的化学平衡常数Kp=_____________________ [已知:气体分压(P分)=气体总压(P)×体积分数]。
(4)氮氧化物也可以用尿素[(NH2)2CO]水溶液吸收。用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为___________________________________ 。
(5)汽车尾气吸收还可利用反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________ (填“>”“<”或“=”)k逆增大的倍数。
②若在1L的恒容密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为80%,则k正︰k逆=_____ L/mol。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1= a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2= b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3= c kJ/mol。
则反应2SO2(g)+ 4NH3·H2O(aq)+ O2(g) = 2(NH4)2SO4(aq)+ 2H2O(l)的ΔH=
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)
| 时间/min 浓度/mol·L−1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~20 min内,平均反应速率v(SO2)=
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
A.通入一定量的O2B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积D.加入高效的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)
①已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×105Pa时,该反应的化学平衡常数Kp=
(4)氮氧化物也可以用尿素[(NH2)2CO]水溶液吸收。用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
(5)汽车尾气吸收还可利用反应2NO(g)+2CO(g)
①达到平衡后,仅升高温度,k正增大的倍数
②若在1L的恒容密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为80%,则k正︰k逆=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网