解答题-原理综合题 适中0.65 引用1 组卷20
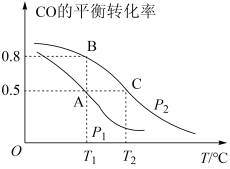
Ⅰ.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是___________ ;平衡常数K=___________ 。平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大”、“不变”成“减小”),CO与CH3OH的浓度比
___________ (填“增大”、“不变”或“减小”)。
(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
(3)若p2压强恒定为p,则平衡常数Kp=___________ (Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s) PH3(g)+HI(g)
PH3(g)+HI(g)
②4PH3(g) P4(g)+6H2(g)
P4(g)+6H2(g)
③2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将___________ (填“增加”、“减小”或“不变”)。
(5)平衡后容器内P4(g)的物质的量___________ 。
(6)求反应①的K___________ 。

(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是
(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
(3)若p2压强恒定为p,则平衡常数Kp=
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s)
②4PH3(g)
③2HI(g)
以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将
(5)平衡后容器内P4(g)的物质的量
(6)求反应①的K
23-24高二上·河南·阶段练习
类题推荐
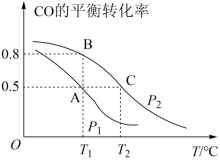
甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为 。往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。CO的平衡转化率与温度、压强的关系如图所示。
。往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。CO的平衡转化率与温度、压强的关系如图所示。

(1)p1、p2的大小关系是p1___________ p2(填“>”“<”或“=”)
(2) A、B、C三点的平衡常数KA、KB、KC由大到小关系是________ 。
(3)列叙述能说明上述反应能达到化学平衡状态的是___________(填字母)。
(4)上述投料在T2℃、p2压强下,平衡时H2的体积分数是___________ ;平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大”“不变”或“减小”)
(5)在T2℃、p2压强时,若p 2压强恒定为p,则平衡常数Kp=___________ (Kp用气体平衡分压代替气体平衡浓度,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。

(1)p1、p2的大小关系是p1
(2) A、B、C三点的平衡常数KA、KB、KC由大到小关系是
(3)列叙述能说明上述反应能达到化学平衡状态的是___________(填字母)。
| A.v正(H2)=v逆(CH3OH) |
| B.CH3OH的体积分数不再改变 |
| C.混合气体的平均摩尔质量不再改变 |
| D.同一时间内,消耗0.04molH2,生成0.02molCO |
(4)上述投料在T2℃、p2压强下,平衡时H2的体积分数是
(5)在T2℃、p2压强时,若p 2压强恒定为p,则平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。