解答题-实验探究题 适中0.65 引用1 组卷281
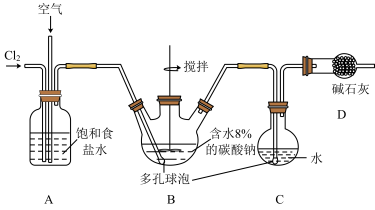
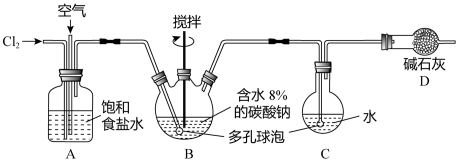
化学工业为疫情防控提供了强有力的物质支撑。次氯酸溶液是常用的消毒剂,可利用Cl2O与水反应得到。根据该原理,某化学兴趣小组利用如图装置制备一定浓度的次氯酸溶液。已知:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解为Cl2和O2。实验时,将氯气和空气(不参与反应)按体积比为1:3混合通入含水8%的碳酸钠糊状物中,请回答下列问题:
(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为_______ 。
(2)装置C中的仪器甲的名称为_______ ,仪器甲中发生反应的化学方程式为_______ 。
(3)装置B的作用为_______ ,有同学建议将装置D中的仪器乙换为棕色瓶,原因是______ 。
(4)测定装置D中得到的次氯酸的物质的量浓度。量取20mL装置D中得到的次氯酸溶液,并稀释至100mL,再从中取出20.00mL至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,滴加0.5mol•L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00mL(反应为2Na2S2O3+I2=Na2S4O6+2NaI)。
①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为_______ 。
②恰好反应时的现象为_______ 。
③装置D中得到的次氯酸的物质的量浓度为_______ mol/L。

(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为
(2)装置C中的仪器甲的名称为
(3)装置B的作用为
(4)测定装置D中得到的次氯酸的物质的量浓度。量取20mL装置D中得到的次氯酸溶液,并稀释至100mL,再从中取出20.00mL至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,滴加0.5mol•L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00mL(反应为2Na2S2O3+I2=Na2S4O6+2NaI)。
①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为
②恰好反应时的现象为
③装置D中得到的次氯酸的物质的量浓度为
23-24高一上·辽宁沈阳·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网