解答题-原理综合题 适中0.65 引用2 组卷67
(1)
ⅰ.
ⅱ.
则ⅲ.
(2)在一定温度下,将
(3)以
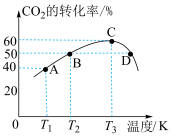
②试分析从A点至C点
③平衡时,若保持温度和压强不变,向容器中充入一定量的
23-24高二上·湖北十堰·期末
类题推荐
党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。 的转化和利用是实现碳中和的有效途径。
的转化和利用是实现碳中和的有效途径。
利用 合成各种化合物可有效降低空气中的
合成各种化合物可有效降低空气中的 含量,实现
含量,实现 的减排和利用。如:
的减排和利用。如:
①

②

③

④

(1)将 和
和 按一定比例充入1L恒容容器,若仅发生反应④,平衡后加入催化剂,此时反应移动的方向为______。
按一定比例充入1L恒容容器,若仅发生反应④,平衡后加入催化剂,此时反应移动的方向为______。
(2)反应③中
______ ,该反应中活化能
______  (填“>”或“<”)。
(填“>”或“<”)。
(3)反应③的自发条件是______ 。
A.高温自发 B.低温自发 C.任何温度下都自发
(4)在催化剂作用下,将2mol 与6mol
与6mol  通入某1L密闭容器中,若只发生①②两个反应。保持体积不变,测得不同温度下,反应经过相同时间时
通入某1L密闭容器中,若只发生①②两个反应。保持体积不变,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示,已知:
的转化率、甲醇的选择性如图所示,已知:
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是______ ,在实际生产中压强不能过高也不能过低,其原因是______ 。
② 时,若反应从开始至a点所用时间为10min,则此时
时,若反应从开始至a点所用时间为10min,则此时 的物质的量=
的物质的量=______ mol,
______  。
。
利用
①
②
③
④
(1)将
| A.正反应方向 | B.逆反应方向 | C.不移动 | D.无法确定 |
(2)反应③中
(3)反应③的自发条件是
A.高温自发 B.低温自发 C.任何温度下都自发
(4)在催化剂作用下,将2mol
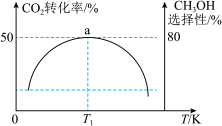
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是
②
利用可见光催化还原 ,将
,将 转化为增值化学原料(HCOOH、HCHO、
转化为增值化学原料(HCOOH、HCHO、 等),被认为是一种可持续的
等),被认为是一种可持续的 资源化有效途径。
资源化有效途径。
(1)已知:







___________  。
。
(2)在一定温度下,将1mol 和3mol
和3mol 通入某恒容密闭容器中,发生反应
通入某恒容密闭容器中,发生反应 ,测得不同时刻容器中
,测得不同时刻容器中 的体积分数
的体积分数 如表所示。
如表所示。
达到平衡时 的转化率为
的转化率为___________ 。
(3)将 的混合气体充入某密闭容器中,同时发生反应Ⅰ和反应Ⅱ。
的混合气体充入某密闭容器中,同时发生反应Ⅰ和反应Ⅱ。
反应Ⅰ:
 。
。
反应Ⅱ:
 。
。
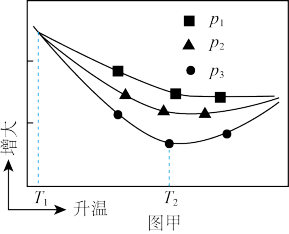
在相同时间内,测得 的平衡转化率随温度、压强的变化关系如图甲。
的平衡转化率随温度、压强的变化关系如图甲。 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ;温度从 到
到 ,
, 转化率变化的主要原因是
转化率变化的主要原因是___________ 。
②在一定温度下,向容积为2L的恒容密闭容器中充入1mol 和3mol
和3mol ,仅发生反应Ⅱ。起始时容器内气体的总压强为8pkPa,若10min时实验测得
,仅发生反应Ⅱ。起始时容器内气体的总压强为8pkPa,若10min时实验测得 的平衡分压为pkPa,则0~10min内,
的平衡分压为pkPa,则0~10min内,
___________  ,该反应的
,该反应的
___________ 。
(4)Bi与BiIn合金催化剂电化学还原 生产HCOOH的催化机理及在催化剂表面还原过程各物质的相对能量变化,如图乙所示(带“*”表示物质处于吸附态)。
生产HCOOH的催化机理及在催化剂表面还原过程各物质的相对能量变化,如图乙所示(带“*”表示物质处于吸附态)。
① 转化为*OCHO效果更好的催化剂
转化为*OCHO效果更好的催化剂___________ 。
②*OCHO转化为HCOOH能垒较大的催化剂___________ 。
(1)已知:
(2)在一定温度下,将1mol
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.215 | 0.205 | 0.200 | 0.200 |
(3)将
反应Ⅰ:
反应Ⅱ:
在相同时间内,测得
②在一定温度下,向容积为2L的恒容密闭容器中充入1mol
(4)Bi与BiIn合金催化剂电化学还原
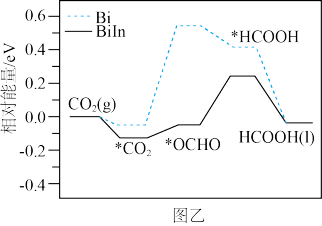
①
②*OCHO转化为HCOOH能垒较大的催化剂
降低空气中二氧化碳的含量、研发二氧化碳的利用技术、将二氧化碳转换为能源是缓解环境和能源问题的有效方案。为实现碳达峰和碳中和的“双碳”目标,工业上用 、
、 、
、 等物质与
等物质与 反应合成具有经济价值的物质。
反应合成具有经济价值的物质。
(1)工业上用 和
和 合成甲醇,发生的主反应ⅰ:
合成甲醇,发生的主反应ⅰ:

___________  。
。
(2)一定条件下,向2L恒温恒容密闭容器中充入1mol (g)和2.8mol
(g)和2.8mol  (g)仅发生反应ⅰ,在两种不同催化剂作用下建立平衡的过程(Ⅰ、Ⅱ)中
(g)仅发生反应ⅰ,在两种不同催化剂作用下建立平衡的过程(Ⅰ、Ⅱ)中 的转化率随反应时间的变化曲线如图。
的转化率随反应时间的变化曲线如图。
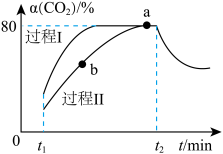
①a点
___________ (填“>”“<”或“=”)b点 。
。
②已知,平衡时a点总压强为p,则该反应的压强平衡常数
___________ 。
③过程Ⅰ, min时刻改变的反应条件可能是
min时刻改变的反应条件可能是___________ (填两条)。
(3) 和
和 合成甲醇的过程中,还会有副反应发生:
合成甲醇的过程中,还会有副反应发生:
反应ⅱ.

反应ⅲ.

将一定量的 (g)和
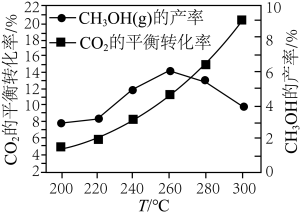
(g)和 (g)充入恒容密闭容器中并加入合适的催化剂,同时发生反应ⅰ、ⅱ、ⅲ。不同温度下体系达到平衡时
(g)充入恒容密闭容器中并加入合适的催化剂,同时发生反应ⅰ、ⅱ、ⅲ。不同温度下体系达到平衡时 的平衡转化率曲线及
的平衡转化率曲线及 (g)的产率曲线如图2所示;相同温度下,在不同压强下测得
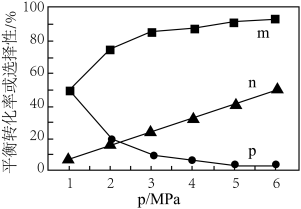
(g)的产率曲线如图2所示;相同温度下,在不同压强下测得 的平衡转化率、
的平衡转化率、 (g)的选择性和CO的选择性随压强的变化曲线如图3所示。
(g)的选择性和CO的选择性随压强的变化曲线如图3所示。
①根据下图判断,当温度高于260℃,CO的浓度随着温度的升高而___________ (填“增大”、“减小”、“不变”或“无法判断”),其原因是___________ 。
②下图中表示CO的选择性的曲线是________ (填“m”、“n”或“p”);试解释随着压强的增大,该曲线呈现这种变化趋势的原因:________ 。
(1)工业上用
| 物质 | ||||
| 相对能量/( | 0 | -201 | -242 | -393 |
(2)一定条件下,向2L恒温恒容密闭容器中充入1mol

①a点
②已知,平衡时a点总压强为p,则该反应的压强平衡常数
③过程Ⅰ,
(3)
反应ⅱ.
反应ⅲ.
将一定量的
①根据下图判断,当温度高于260℃,CO的浓度随着温度的升高而

②下图中表示CO的选择性的曲线是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


