解答题-实验探究题 适中0.65 引用1 组卷16
Ⅰ.实验室用如图所示简易量热计进行中和热的测定实验,请回答。
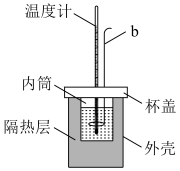
(1)图中仪器b的名称是_______ ;
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式_______ ;
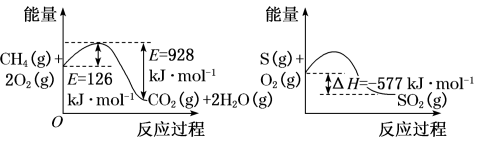
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为_______ ,决定总反应速率的是第_______ 步基元反应。
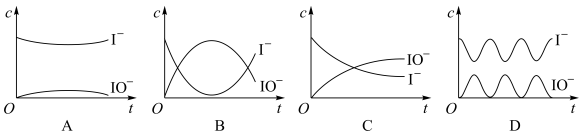
(4)反应过程中I-和IO-的浓度变化趋势为_______ 。
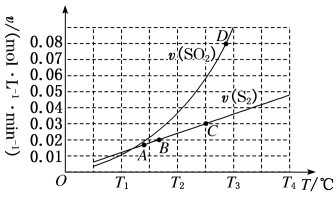
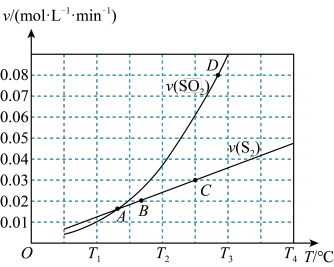
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g) S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
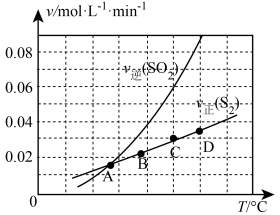
(5)A、B、C、D四点对应的状态中,达到平衡状态的有_______ (填字母)。
(6)该反应的△H_______ 0(填>、<或=)。
(7)下列措施能够增大SO2平衡转化率的是_______。

(1)图中仪器b的名称是
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为
(4)反应过程中I-和IO-的浓度变化趋势为

Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g)

(5)A、B、C、D四点对应的状态中,达到平衡状态的有
(6)该反应的△H
(7)下列措施能够增大SO2平衡转化率的是_______。
| A.降温 | B.增加C(s)的量 |
| C.减小容器体积 | D.恒压通入一定量SO2 |
23-24高二上·重庆黔江·阶段练习
类题推荐
氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)⇌2NO2(g) ΔH=-114.0kJ·mol-1
2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.0kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
(1)写出NO2和SO2反应的热化学方程式为____________ 。
(2)随温度升高,该反应化学平衡常数变化趋势是_____ (填增大、不变、减小)。
II.(3)已知4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
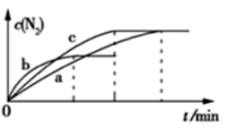
①与容器a中的反应相比,容器c中的反应改变的实验条件可能是_______ ,
②一定温度下,下列能说明反应已达到平衡状态的是_________
A.混合气体的密度保持不变 B.H2O(g)与NO的生成速率相等
C.ΔH保持不变 D.容器的总压强保持不变
(4)水煤气变换[CO(g)+H2O(g)⇌CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
①在800℃、2L密闭容器中,若充入4mol CO和3mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成2mol CO2,则该反应的速率v(CO)为____ ,该温度下的平衡常数K为_ ,CO平衡转化率为____ 。
②一氧化碳和水蒸气的反应历程如图,下列说法不正确的是_____
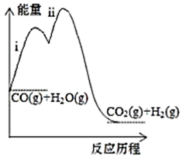
a.该反应放热
b.反应ii活化能大于反应i
c.该反应经过两步基元反应完成
d.使用催化剂降低反应的ΔH,反应速率加快
③将CO和水蒸气混合气体充入容积相等的三个恒温、恒容密闭容器中,使其在相同温度下反应,获得如下数据:
下列说法正确的是___________
a.t1=t2 Q1=Q2
b.CO转化率:α3=α1
c.平衡时CO2浓度:c3=2c1
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)⇌2NO2(g) ΔH=-114.0kJ·mol-1
2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.0kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
(1)写出NO2和SO2反应的热化学方程式为
(2)随温度升高,该反应化学平衡常数变化趋势是
II.(3)已知4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。

①与容器a中的反应相比,容器c中的反应改变的实验条件可能是
②一定温度下,下列能说明反应已达到平衡状态的是
A.混合气体的密度保持不变 B.H2O(g)与NO的生成速率相等
C.ΔH保持不变 D.容器的总压强保持不变
(4)水煤气变换[CO(g)+H2O(g)⇌CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
①在800℃、2L密闭容器中,若充入4mol CO和3mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成2mol CO2,则该反应的速率v(CO)为
②一氧化碳和水蒸气的反应历程如图,下列说法不正确的是

a.该反应放热
b.反应ii活化能大于反应i
c.该反应经过两步基元反应完成
d.使用催化剂降低反应的ΔH,反应速率加快
③将CO和水蒸气混合气体充入容积相等的三个恒温、恒容密闭容器中,使其在相同温度下反应,获得如下数据:
| 容器编号 | 各物质起始量/mol | 达平衡时间/min | 达平衡时体系能量变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| 1 | 1 | 1 | 0 | 0 | t1 | Q1 |
| 2 | 0 | 0 | 1 | 1 | t2 | Q2 |
| 3 | 2 | 2 | 0 | 0 | t3 | Q3 |
下列说法正确的是
a.t1=t2 Q1=Q2
b.CO转化率:α3=α1
c.平衡时CO2浓度:c3=2c1
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网