解答题-实验探究题 适中0.65 引用1 组卷106
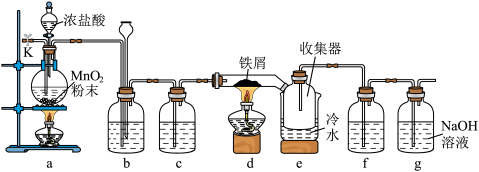
实验室制备并收集无水 的装置如图所示(部分夹持装置略)。已知
的装置如图所示(部分夹持装置略)。已知 在空气中易潮解,300℃左右升华。
在空气中易潮解,300℃左右升华。
实验步骤如下:
Ⅰ.连接仪器,检查气密性,装入药品:
Ⅱ.打开分液漏斗活塞,点燃装置a处酒精灯,当……点燃装置d处酒精灯;
Ⅲ.反应结束,熄灭装置d处酒精灯,待硬质玻璃管冷却至室温;
Ⅳ.关闭分液漏斗活塞,熄灭装置a处酒精灯;
Ⅴ.从k处通入一段时间干燥空气后,拆卸装置并及时密封收集器。
回答下列问题:
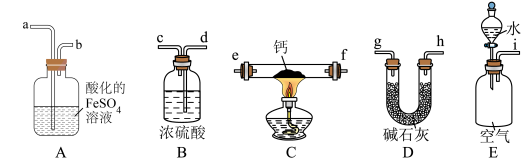
(1)装置a中反应的离子方程式为___________ ;装置b中的试剂为___________ ;
装置d中反应的化学方程式为___________ 。
(2)补全步骤Ⅱ中相应的实验现象___________ ;步骤Ⅴ中通入一段时间干燥空气的目的是___________ ;若操作Ⅲ和Ⅳ调换顺序,可能造成的后果是___________ 。
(3)现有含少量杂质的 ,为测定
,为测定 值进行如下实验:
值进行如下实验:
①称取 样品配成250mL溶液,加入过量锌粒将
样品配成250mL溶液,加入过量锌粒将 还原为
还原为 ,过滤;取25.00mL所得滤液,恰好与
,过滤;取25.00mL所得滤液,恰好与 的
的 溶液完全反应;
溶液完全反应;
(已知 未配平,杂质、
未配平,杂质、 、
、 不参与反应)。
不参与反应)。
②另取 样品,在脱水剂
样品,在脱水剂 蒸汽作用下,加热至恒重,测得固体质量为
蒸汽作用下,加热至恒重,测得固体质量为 。(
。( 遇水极易反应生成气体,该过程中
遇水极易反应生成气体,该过程中 未升华)。
未升华)。
则配制样品溶液时,用到的玻璃仪器有_________ 、玻璃棒、烧杯和胶头滴管;
__________ ,下列情况会导致 测量值偏小的是
测量值偏小的是____________ (填标号)。
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与 反应时,失水不充分
反应时,失水不充分

实验步骤如下:
Ⅰ.连接仪器,检查气密性,装入药品:
Ⅱ.打开分液漏斗活塞,点燃装置a处酒精灯,当……点燃装置d处酒精灯;
Ⅲ.反应结束,熄灭装置d处酒精灯,待硬质玻璃管冷却至室温;
Ⅳ.关闭分液漏斗活塞,熄灭装置a处酒精灯;
Ⅴ.从k处通入一段时间干燥空气后,拆卸装置并及时密封收集器。
回答下列问题:
(1)装置a中反应的离子方程式为
装置d中反应的化学方程式为
(2)补全步骤Ⅱ中相应的实验现象
(3)现有含少量杂质的
①称取
(已知
②另取
则配制样品溶液时,用到的玻璃仪器有
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与
23-24高一上·山东淄博·期末
类题推荐
I.铁及其化合物在工业生产中有着重要的用途,其“价—类”二维图如图。

(1)下列推断不合理的是______ 。
(2)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是______ 。
a.若无固体存在,则溶液中一定有Fe3+
b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则可能有固体存在
d.若溶液中有Fe3+,则可能有Cu析出
Ⅱ.现有含少量杂质的FeCl3•nH2O,为测定n值进行如下实验:
①称取ag样品配成250mL溶液,加入稍过量锌粒将Fe3+还原为Fe2+,过滤;取25.00mL所得滤液,恰好与VmLcmol/L的K2Cr2O7溶液完全反应;
(已知Cr2O +Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
+Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
②另取ag样品,在脱水剂SOCl2蒸汽作用下,加热至恒重,测得固体质量为bg。(SOCl2遇水极易反应生成气体,该过程中FeCl3未升华)。
(3)加入稍过量的锌粒后,检验溶液中是否存在Fe3+的试剂为_______ 。
(4)若将SO2通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:_______ 。
(5)n=_______ ,下列情况会导致n测量值偏小的是_______ (填标号)。
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与SOCl2反应时,失水不充分

(1)下列推断不合理的是
| A.FeCl2和FeCl3可通过化合反应相互转化 |
| B.Fe2+既可被氧化,也可被还原 |
| C.FeO在空气中受热,能迅速生成Fe2O3 |
| D.存在Fe3+→Fe2+→Fe(OH)2→Fe(OH)3→Fe3+的循环转化关系 |
(2)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
a.若无固体存在,则溶液中一定有Fe3+
b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则可能有固体存在
d.若溶液中有Fe3+,则可能有Cu析出
Ⅱ.现有含少量杂质的FeCl3•nH2O,为测定n值进行如下实验:
①称取ag样品配成250mL溶液,加入稍过量锌粒将Fe3+还原为Fe2+,过滤;取25.00mL所得滤液,恰好与VmLcmol/L的K2Cr2O7溶液完全反应;
(已知Cr2O
②另取ag样品,在脱水剂SOCl2蒸汽作用下,加热至恒重,测得固体质量为bg。(SOCl2遇水极易反应生成气体,该过程中FeCl3未升华)。
(3)加入稍过量的锌粒后,检验溶液中是否存在Fe3+的试剂为
(4)若将SO2通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:
(5)n=
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与SOCl2反应时,失水不充分
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网