解答题-实验探究题 适中0.65 引用1 组卷54
甘氨酸亚铁[(NH2CH2COO)2Fe,M=204g•mol﹣1]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某化学兴趣小组在实验室利用 FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,有关物质性质如下表所示:
实验过程如下:
Ⅰ.制备 FeCO3:
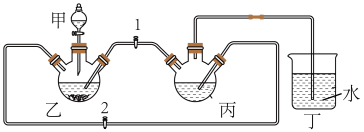
实验小组将足量的废铁屑和 500mL 1.0mol•L﹣1稀硫酸反应,再与200mL 1.0mol•L﹣1NH4HCO3溶液充分混合,装置如图所示,反应结束后过滤并洗涤沉淀。
(1)装置丙中发生反应的离子方程式为_________ 。
(2)部分实验操作过程如下,请按正确操作顺序填入字母:________ 。
搭建装置并检查装置气密性→在各个装置中加入试剂→___→____→___→观察到装置丁中有大量气泡冒出→___→待装置甲中液体完全流下→___→__→开动装置丙所连接的搅拌器→∙∙∙∙∙∙。
a.关闭开关 3;b.盖上装置甲上口玻璃塞;c.关闭开关 2,打开开关 1;d.关闭开关 1,打开开关 2;e.打开装置甲上口玻璃塞;f.打开开关 3。
Ⅱ.制备(NH2CH2COO)2Fe:
将步骤Ⅰ得到的沉淀全部转移到装置C中,同时加入200mL 1.0mol•L﹣1甘氨酸溶液。先打开仪器 a 的活塞,待整套装置中空气排净后,加热装置C并不断搅拌;然后向装置 C 中滴加柠檬酸溶液。反应物充分反应后,向装置C中加入无水乙醇,立即出现白色沉淀,过滤得到甘氨酸亚铁粗品,再对粗品进行纯化。
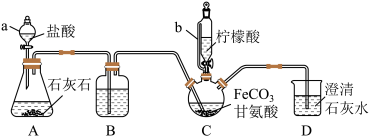
(3)装置 D 的作用___________ 。
(4)在甘氨酸亚铁的制备过程中,溶液 pH 与甘氨酸亚铁产率的关系如图所示。
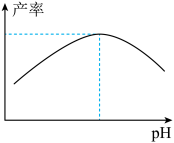
①pH 过低或过高均导致产率下降,其原因是________ 。
②柠檬酸的作用有________ 。
(5)下列关于整个实验过程的说法中正确的是________。
(6)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于 FeSO4溶液。请分析甘氨酸亚铁不易氧化,久储不变的原因_______ 。
(7)纯化后最终得到 15.3g 甘氨酸亚铁,则其产率是_____ %。
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
| 有强酸性和还原性 | 不易氧化,久储不变 |
Ⅰ.制备 FeCO3:
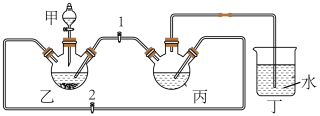
实验小组将足量的废铁屑和 500mL 1.0mol•L﹣1稀硫酸反应,再与200mL 1.0mol•L﹣1NH4HCO3溶液充分混合,装置如图所示,反应结束后过滤并洗涤沉淀。

(1)装置丙中发生反应的离子方程式为
(2)部分实验操作过程如下,请按正确操作顺序填入字母:
搭建装置并检查装置气密性→在各个装置中加入试剂→___→____→___→观察到装置丁中有大量气泡冒出→___→待装置甲中液体完全流下→___→__→开动装置丙所连接的搅拌器→∙∙∙∙∙∙。
a.关闭开关 3;b.盖上装置甲上口玻璃塞;c.关闭开关 2,打开开关 1;d.关闭开关 1,打开开关 2;e.打开装置甲上口玻璃塞;f.打开开关 3。
Ⅱ.制备(NH2CH2COO)2Fe:
将步骤Ⅰ得到的沉淀全部转移到装置C中,同时加入200mL 1.0mol•L﹣1甘氨酸溶液。先打开仪器 a 的活塞,待整套装置中空气排净后,加热装置C并不断搅拌;然后向装置 C 中滴加柠檬酸溶液。反应物充分反应后,向装置C中加入无水乙醇,立即出现白色沉淀,过滤得到甘氨酸亚铁粗品,再对粗品进行纯化。

(3)装置 D 的作用
(4)在甘氨酸亚铁的制备过程中,溶液 pH 与甘氨酸亚铁产率的关系如图所示。

①pH 过低或过高均导致产率下降,其原因是
②柠檬酸的作用有
(5)下列关于整个实验过程的说法中正确的是________。
| A.步骤Ⅰ中的废铁屑要预先用热的饱和 Na2CO3溶液浸泡,并用倾析法洗涤数次至中性 |
| B.步骤Ⅰ采用较大废铁屑而不是铁粉的主要原因是防止反应过于剧烈,铁粉顺着导管从装置乙被压入装置丙中,使得制得的 FeCO3中混有杂质 |
| C.装置 B 中盛有的试剂是饱和 Na2CO3溶液 |
| D.粗品纯化的方法是:先用冰水洗涤,再用无水乙醇洗涤,置于真空干燥机中干燥。 |
(6)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于 FeSO4溶液。请分析甘氨酸亚铁不易氧化,久储不变的原因
(7)纯化后最终得到 15.3g 甘氨酸亚铁,则其产率是
23-24高一上·陕西商洛·期末
类题推荐
甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组在实验室利用直接合成法制各甘氨酸亚铁。有关物质性质如下所示:
实验过程及装置图如下(夹持和加热仪器已省略):

I.合成:在C中加入0.10mol甘氨酸、0.05mol硫酸亚铁、少量柠檬酸和200mL水,利用CO2将C装置中的空气排净,然后在40℃恒温条件下用磁力搅拌器不断搅拌,并用恒压滴液漏斗向C中滴加6mol·L-1NaOH溶液调节pH到6左右,使反应物充分反应。
II.分离:加入无水乙醇,立即出现白色沉淀。将沉淀进行过滤、洗涤,收集滤渣。
Ⅲ.提纯:将滤渣溶解于适量的蒸馏水中,然后结晶、过滤,将纯化后的产品放入真空干燥箱中干燥后称重。
回答下列问题:
(1)B装置的作用是______________ ;
(2)能证明C装置中空气排净的现象是______________ ;向C中滴加NaOH溶液之前应该停止滴加盐酸,且关闭止水夹____________ ,打开止水夹________
(3)“合成”中加入柠檬酸的作用是______________ :请写出合成甘氨酸亚铁的化学方程式_________ 。
(4)加入乙醇的目的是________ ;“提纯”时用的结晶方法为________________
(5)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。暴露在空气中,(NH2CH2COO)2Fe溶液比FeSO4溶液难被氧化,请分析原因为________
(6)若产品质量为ag,则产率为________ %。
| 甘氨酸( NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、 | 易溶于水和乙醇, | 易溶于水, |
| 两性化合物 | 有强酸性和还原性 | 难溶于乙醇 |

I.合成:在C中加入0.10mol甘氨酸、0.05mol硫酸亚铁、少量柠檬酸和200mL水,利用CO2将C装置中的空气排净,然后在40℃恒温条件下用磁力搅拌器不断搅拌,并用恒压滴液漏斗向C中滴加6mol·L-1NaOH溶液调节pH到6左右,使反应物充分反应。
II.分离:加入无水乙醇,立即出现白色沉淀。将沉淀进行过滤、洗涤,收集滤渣。
Ⅲ.提纯:将滤渣溶解于适量的蒸馏水中,然后结晶、过滤,将纯化后的产品放入真空干燥箱中干燥后称重。
回答下列问题:
(1)B装置的作用是
(2)能证明C装置中空气排净的现象是
(3)“合成”中加入柠檬酸的作用是
(4)加入乙醇的目的是
(5)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。暴露在空气中,(NH2CH2COO)2Fe溶液比FeSO4溶液难被氧化,请分析原因为
(6)若产品质量为ag,则产率为
甘氨酸亚铁[(NH2CH2COO)2Fe]是一种新型补铁剂,广泛用于缺铁性贫血的预防和治疗。某化学学习小组用如图所示装置(夹持仪器省略)制备甘氨酸亚铁。
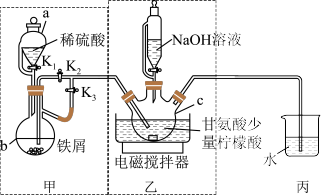
有关物质性质如表所示:
实验步骤如下:
Ⅰ.通过甲装置产生的气体赶尽仪器c中空气后,将仪器b中溶液加入到仪器c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向仪器c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向仪器c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是_______ , 丙装置的作用是_______ 。
(2)步骤Ⅰ中赶尽仪器c中空气的具体操作是_______ ,将仪器b中溶液加入到仪器c中的操作是_______
(3)步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质_______ 。(写化学式)
(4)仪器c中生成甘氨酸亚铁的化学方程式是_______ 。
(5)原料中柠檬酸的作用是_______ ,步骤Ⅲ中洗涤沉淀时使用的洗涤剂是_______ (填物质名称),粗产品纯化的操作名称是_______
(6)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。其原因是_______

有关物质性质如表所示:
| 甘氨酸(NH2CH2COOH) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中溶解度大于在乙醇中的溶解度 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性 |
| 甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸 |
Ⅰ.通过甲装置产生的气体赶尽仪器c中空气后,将仪器b中溶液加入到仪器c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向仪器c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向仪器c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是
(2)步骤Ⅰ中赶尽仪器c中空气的具体操作是
(3)步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质
(4)仪器c中生成甘氨酸亚铁的化学方程式是
(5)原料中柠檬酸的作用是
(6)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。其原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网