解答题-实验探究题 适中0.65 引用1 组卷118
Ⅰ.硫酸酸化的高锰酸钾溶液与草酸发生化学反应,反应如下:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,某化学兴趣小组为了测定草酸浓度,主要做了如下实验。用0.1000mol/L酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液。实验中测得的数据记录如下:
回答问题:
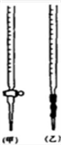
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的______ (填字母代号)。

(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于______ 滴定管。滴定时,眼睛应注视______ 。
(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是________ 。
(4)根据表中数据,计算H2C2O4溶液的浓度_________ 。
(5)下列造成H2C2O4溶液的浓度偏高的是________。
Ⅱ.氧化还原滴定,可用于 粗产品的纯度测定。
粗产品的纯度测定。
称取m g产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用 标准溶液滴定至终点(
标准溶液滴定至终点( ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。
(6)加入KI和稀 后发生反应的离子方程式为
后发生反应的离子方程式为_________ 。
(7)滴定终点的现象为________ ,则产品中 的质量分数为
的质量分数为_______ %。
| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.41mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 1.04mL | 22.47mL |
| 4 | 25.00mL | 0.04mL | 24.46 mL |
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的

(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于
(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是
(4)根据表中数据,计算H2C2O4溶液的浓度
(5)下列造成H2C2O4溶液的浓度偏高的是________。
| A.滴定终点读数时俯视 | B.滴定前有气泡,滴定后气泡消失 |
| C.润洗锥形瓶 | D.滴定过程中加入少量蒸馏水冲洗瓶壁 |
Ⅱ.氧化还原滴定,可用于
称取m g产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用
(6)加入KI和稀
(7)滴定终点的现象为
23-24高二上·辽宁葫芦岛·期末
类题推荐
滴定法是化学分析常用方法,是一种简便、快速和应用广泛的定量分析方法。
Ⅰ.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用 NaOH 固体配制 0.1000mol/L 的 NaOH 溶液 240mL。
①本实验必须用到的仪器有天平、 药匙、 玻璃棒、 胶头滴管、 烧杯、___________ 。
②要完成本实验该同学应称出 NaOH 的质量为___________ g。
(2)取25.00mL 待测液于250mL 锥形瓶中,加入2~3滴指示剂,用0.1000mol/L NaOH 标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①三次实验数据记录如表所示:
根据表中数据计算出醋酸待测液的浓度为___________ 。
②在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有___________ (填序号)。
a. 量取标准液的碱式滴定管未用标准液润洗
b. 取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c. 锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d. 当滴定结束时,俯视碱式滴定管读数
Ⅱ.氧化还原滴定与酸碱中和滴定类似,可用于 KIO3粗产品的纯度测定。
称取 mg 产品配成250mL溶液,取25.00mL 溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用C mol/L Na2S2O3标准溶液滴定至终点 ,平均消耗标准溶液的体积为 VmL。
,平均消耗标准溶液的体积为 VmL。
(3)加入KI和稀H2SO₄后发生反应的离子方程式为___________ 。
(4)滴定终点的现象为___________ , 则产品中KIO3的质量分数为___________ %。
Ⅰ.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用 NaOH 固体配制 0.1000mol/L 的 NaOH 溶液 240mL。
①本实验必须用到的仪器有天平、 药匙、 玻璃棒、 胶头滴管、 烧杯、
②要完成本实验该同学应称出 NaOH 的质量为
(2)取25.00mL 待测液于250mL 锥形瓶中,加入2~3滴指示剂,用0.1000mol/L NaOH 标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①三次实验数据记录如表所示:
| 滴定次数 | 滴定前碱式滴定管读数/mL | 滴定后碱式滴定管读数/mL |
| 1 | 1.00 | 30.95 |
| 2 | 2.03 | 29.23 |
| 3 | 0.56 | 30.61 |
②在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有
a. 量取标准液的碱式滴定管未用标准液润洗
b. 取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c. 锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d. 当滴定结束时,俯视碱式滴定管读数
Ⅱ.氧化还原滴定与酸碱中和滴定类似,可用于 KIO3粗产品的纯度测定。
称取 mg 产品配成250mL溶液,取25.00mL 溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用C mol/L Na2S2O3标准溶液滴定至终点
(3)加入KI和稀H2SO₄后发生反应的离子方程式为
(4)滴定终点的现象为
滴定法是化学分析常用方法,是一种简便、快速和应用广泛的定量分析方法。
I.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用NaOH固体配制0.1000mol/L的NaOH溶液240mL。
①本实验必须用到的仪器有天平、药匙、玻璃棒、胶头滴管、烧杯、_____ 。
②要完成本实验该同学应称出NaOH的质量为_____ g。
(2)取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为_____ ;
②滴定时边滴边摇动锥形瓶,眼睛注视_____ ;
③三次实验数据记录如表所示:
根据表中数据计算出醋酸待测液的浓度为_____ 。
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_____ (填序号)。
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO₃粗产品的纯度测定。
称取mg产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用 标准溶液滴定至终点(
标准溶液滴定至终点( ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。
(3)加入KI和稀H₂SO₄后发生反应的离子方程式为_____ 。
(4)滴定终点的现象为_____ ,则产品中KIO3的质量分数为_____ %。
I.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用NaOH固体配制0.1000mol/L的NaOH溶液240mL。
①本实验必须用到的仪器有天平、药匙、玻璃棒、胶头滴管、烧杯、
②要完成本实验该同学应称出NaOH的质量为
(2)取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为
②滴定时边滴边摇动锥形瓶,眼睛注视
③三次实验数据记录如表所示:
| 滴定次数 | 滴定前碱式滴定管读数/mL | 滴定后碱式滴定管读数/mL |
| 1 | 1.00 | 30.95 |
| 2 | 2.03 | 29.23 |
| 3 | 0.56 | 30.61 |
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO₃粗产品的纯度测定。
称取mg产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用
(3)加入KI和稀H₂SO₄后发生反应的离子方程式为
(4)滴定终点的现象为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网