解答题-原理综合题 适中0.65 引用2 组卷85
乙烯的产量是衡量一个国家石油化工发展水平的标志,近几年各国都加大了乙烯制备的研发力度。回答下列问题:
(1)乙烷分解法
已知CO的燃烧热为 。以
。以 和
和 为原料可以协同制取
为原料可以协同制取 和CO,发生的反应如下:
和CO,发生的反应如下:
反应1:

反应2:

① 的
的
_____  。
。
②恒温条件下,下列能够提高反应 中乙烯产率的措施有
中乙烯产率的措施有______ (填标号)。
A.保持体积不变,通入氮气 B.保持压强不变,通入乙烷
C.保持体积不变,通入乙烷 D.及时分离出氢气
③恒温恒压(100kPa)下,在密闭容器中通入乙烷和稀有气体,平衡时各组分的体积分数分别为:乙烷5%、氢气20%、乙烯20%。该温度下反应 的平衡常数
的平衡常数
_____ kPa(用物质的平衡分压代替平衡浓度,平衡分压=总压强×体积分数)。
(2)二氧化碳转化法反应原理为 。在体积固定的密闭容器中,加入一定量的
。在体积固定的密闭容器中,加入一定量的 、
、 和催化剂,一段时间内测得二氧化碳的浓度变化如图1所示。在相同时间段内,测得乙烯的体积分数随温度变化如图2所示。
和催化剂,一段时间内测得二氧化碳的浓度变化如图1所示。在相同时间段内,测得乙烯的体积分数随温度变化如图2所示。
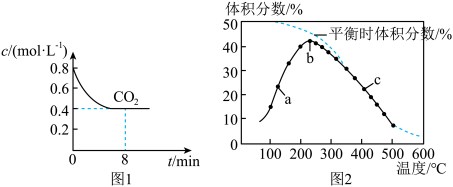
①由图1可知,0~8min用乙烯表示的平均反应速率为______  。
。
②图2中,a、b、c三点表示的化学平衡常数由大到小的顺序为______ ;b点的反应速率
___  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
③b点后乙烯的体积分数随温度升高逐渐减小的原因可能是_______ 、_______ (任写两条)。
④实验测定,反应中, (
( 、
、 为速率常数,只与温度有关),精确实验表明,达到平衡时
为速率常数,只与温度有关),精确实验表明,达到平衡时 的值为
的值为 的2倍,则该反应的平衡常数
的2倍,则该反应的平衡常数
_______ 。
(1)乙烷分解法
已知CO的燃烧热为
反应1:
反应2:
①
②恒温条件下,下列能够提高反应
A.保持体积不变,通入氮气 B.保持压强不变,通入乙烷
C.保持体积不变,通入乙烷 D.及时分离出氢气
③恒温恒压(100kPa)下,在密闭容器中通入乙烷和稀有气体,平衡时各组分的体积分数分别为:乙烷5%、氢气20%、乙烯20%。该温度下反应
(2)二氧化碳转化法反应原理为

①由图1可知,0~8min用乙烯表示的平均反应速率为
②图2中,a、b、c三点表示的化学平衡常数由大到小的顺序为
③b点后乙烯的体积分数随温度升高逐渐减小的原因可能是
④实验测定,反应中,
23-24高三上·河南安阳·阶段练习
类题推荐
乙烯是有机合成工业重要的原料,由乙烷制取乙烯是常见的方法。已知乙烷热裂解法制取乙烯的反应为
 。
。
(1)一定温度下,在乙烷热裂解制取乙烯时,向体系中充入一定量惰性气体,保持体系的总压强为100kPa,测得平衡时各组分的体积分数如下表所示:
该温度下反应的平衡常数
_______ kPa,(用物质的平衡分压代替平衡浓度,平衡分压=总压强X体积分数)
(2)利用膜分离技术可以实现边反应边分离出生成的 。在容积为1L的恒容密闭容器中充入1mol乙烷,测得不同氢气移出率α[
。在容积为1L的恒容密闭容器中充入1mol乙烷,测得不同氢气移出率α[ ]条件下,乙烷的平衡转化率与和温度的关系如图-1所示。
]条件下,乙烷的平衡转化率与和温度的关系如图-1所示。
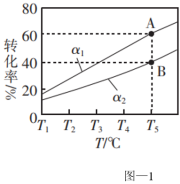
①α1_______ (填“>”、“<”或“=”) α2。
②若A点时平衡常数K=0.8,则α1=_______ 。
(3)以 和
和 为原料可以协同制取
为原料可以协同制取 和CO,发生的反应如下:
和CO,发生的反应如下:
反应1:

反应2:

①已知
 。
。
则 的
的
_______  。
。
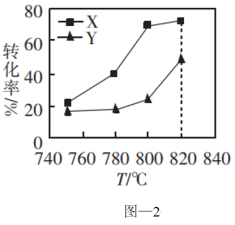
②0.1MPa时,按物质的量之比为1:1向密闭容器中充入 和
和 的混合气体,反应相同时间,测得
的混合气体,反应相同时间,测得 和
和 的转化率与温度的关系如图-2所示。X代表的物质是
的转化率与温度的关系如图-2所示。X代表的物质是_______ 。750~820℃时,随着温度的升高,容器中 的值的变化情况是
的值的变化情况是_______ 。
③乙烷热裂解时,会产生积碳,以 和
和 为原料协同制取
为原料协同制取 和CO会减少积碳的产生,原因是
和CO会减少积碳的产生,原因是_______ 。
(1)一定温度下,在乙烷热裂解制取乙烯时,向体系中充入一定量惰性气体,保持体系的总压强为100kPa,测得平衡时各组分的体积分数如下表所示:
| 物质 | |||
| 体积分数 | 5% | 20% | 20% |
(2)利用膜分离技术可以实现边反应边分离出生成的

①α1
②若A点时平衡常数K=0.8,则α1=
(3)以
反应1:
反应2:
①已知
则
②0.1MPa时,按物质的量之比为1:1向密闭容器中充入

③乙烷热裂解时,会产生积碳,以
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网