解答题-原理综合题 较难0.4 引用1 组卷91
氮氧化物 排放到大气中会严重危害人体健康。
排放到大气中会严重危害人体健康。 技术是去除NOx最为有效的技术之一,在催化剂条件下,以
技术是去除NOx最为有效的技术之一,在催化剂条件下,以 将尾气中NOx还原为
将尾气中NOx还原为 从而降低污染。
从而降低污染。
(1)反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

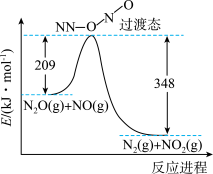
则:ΔH3=_______ kJ/mol
(2)用 去除尾气中的NOx,当
去除尾气中的NOx,当 时,可发生“快速
时,可发生“快速 反应”,其有利于增大NOx脱除率。该反应的化学方程式为
反应”,其有利于增大NOx脱除率。该反应的化学方程式为___________ 。
(3)研究发现加入臭氧会发生反应: ,对
,对 技术去除NOx有一定的辅助作用。
技术去除NOx有一定的辅助作用。 时,
时, 脱除率较高,原因是
脱除率较高,原因是___________ 。
(4)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,仅发生反应Ⅱ,起始压强为
,仅发生反应Ⅱ,起始压强为 ,反应过程中
,反应过程中 的物质的量如下表所示:
的物质的量如下表所示:
 内,该反应的平均反应速率
内,该反应的平均反应速率
___________ 。该反应的平衡常数
___________ (列出计算式)。
(5)利用隔膜电解法脱除废气中的 的装置如图所示。
的装置如图所示。
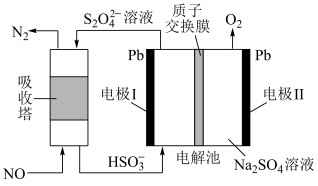
电解池中阴极的电极反应式为___________ 。当处理 的物质的量为
的物质的量为 时,阳极区电解质溶液的质量减少
时,阳极区电解质溶液的质量减少___________  。
。
(1)反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
则:ΔH3=
(2)用
(3)研究发现加入臭氧会发生反应:
(4)一定温度下,向
| 0 | 5 | 10 | 20 | 30 | 40 | |
| 1 | 0.8 | 0.7 | 0.6 | 0.6 | 0.6 |
(5)利用隔膜电解法脱除废气中的

电解池中阴极的电极反应式为
23-24高三上·湖北·期末
类题推荐
Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因_________________ (用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________ 。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+ O2(g)=CO2(g) △H1=-282.0 KJ/mol
O2(g)=CO2(g) △H1=-282.0 KJ/mol
H2(g)+ O2(g)=H2O(g) △H2=-241.8 KJ/mol
O2(g)=H2O(g) △H2=-241.8 KJ/mol
CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________ 。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
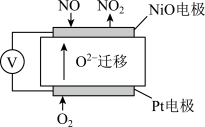
①Pt电极上发生的是______________ 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________ ;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
0~5min内,该反应的平均反应速率V(NO)=___________________ ;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+
H2(g)+
CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:

①Pt电极上发生的是
②NiO电极上的电极反应式为
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
| 时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
| 比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是
研究将汽车尾气中含有的NO、CO等有害物质变废为宝,具有非常重要的现实意义。回答下列问题:
(1)NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3、CH4将尾气中NOx还原为N2从而降低污染。
已知:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H1=-906.5kJ•mol-1
4NO(g)+6H2O(g) △H1=-906.5kJ•mol-1
反应Ⅱ:N2(g)+O2(g) 2NO(g) △H2=+229.3kJ•mol-1
2NO(g) △H2=+229.3kJ•mol-1
①则反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H3=
5N2(g)+6H2O(g) △H3=_______ kJ•mol-1。
②用NH3去除尾气中的NOx,当V(NO):V(NO2)=1:1时称为“快速SCR反应”,该反应的化学方程式为______ 。
(2)用CH4消除NO2污染的反应为CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H=bkJ•mol-1。在10L密闭容器中分别加入0.50molCH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示。
N2(g)+CO2(g)+2H2O(g) △H=bkJ•mol-1。在10L密闭容器中分别加入0.50molCH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示。
由实验数据可知:b_______ 0(填“>”或“<”)。40min时,表格中M对应的数据为_______ 。
(3)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。在一定温度下,向2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(
N2(g)+2CO2(g)。在一定温度下,向2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值( )如表。
)如表。
0~5min内,该反应的平均反应速率v(N2)=______ 。该反应的平衡常数K=_______ (保留三位有效数字)。
(4)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g) NH2CO2NH4(s);②NH2CO2NH4(s)
NH2CO2NH4(s);②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)。对于上述反应②,在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时p[H2O(g)]为aPa,若反应温度不变,将体系的体积减小50%,至达新平衡的过程中p[H2O(g)]的取值范围是
CO(NH2)2(s)+H2O(g)。对于上述反应②,在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时p[H2O(g)]为aPa,若反应温度不变,将体系的体积减小50%,至达新平衡的过程中p[H2O(g)]的取值范围是_______ (用含a的式子表示)。
(1)NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3、CH4将尾气中NOx还原为N2从而降低污染。
已知:
反应Ⅰ:4NH3(g)+5O2(g)
反应Ⅱ:N2(g)+O2(g)
①则反应Ⅲ:4NH3(g)+6NO(g)
②用NH3去除尾气中的NOx,当V(NO):V(NO2)=1:1时称为“快速SCR反应”,该反应的化学方程式为
(2)用CH4消除NO2污染的反应为CH4(g)+2NO2(g)
| 组别 | 温度/K | 物质的量/mol 时间/min | 0 | 10 | 20 | 40 | 50 |
| ① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| ② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
(3)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为2NO(g)+2CO(g)
| 时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
| 比值( | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
(4)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)