
提新型锂电池的正极材料,可由菱锰矿(主要含

,含有少量Fe、Ni、Al等元素)经过如下过程制得:

(1)“酸浸”时使用硫酸,浸出液中主要含有的金属阳离子是

,还含有少量

、

和

。“氧化”时向浸出液中滴加

溶液除去

,当

溶液滴加过量后,溶液中

的物质的量逐渐减小,原因是
___________。
(2)“除杂”时先调节溶液的

,将

和

沉淀完全,继续向溶液中加入BaS固体(可溶于水),可将

转化为NiS沉淀。当

沉淀完全而

不沉淀的原因是
___________。[已知金属离子浓度小于

mol⋅L
-1时可认为沉淀完全,除杂时溶液中

mol⋅L
-1。

,

]
(3)“电解”时可制得

,同时电解液可循环使用。电解液中可循环使用的物质是
___________。
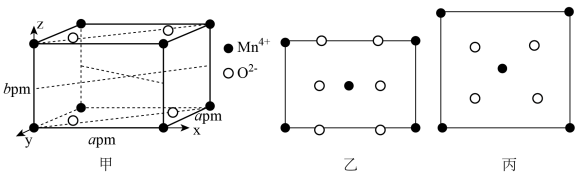
(4)

的一种晶胞结构如下图甲所示,图甲中表示出晶胞的边长及坐标轴,晶胞中部分

和

未标出,图乙为沿y轴方向晶胞投影图,图丙为沿z轴方向晶胞投影图,请在图甲上用“●”和“○”补充完整所缺的

和

。
_________
(5)将

与

固体混合煅烧可制得

,为测定制得

样品的纯度,现进行如下实验:称取0.800 g样品,加入足量硫酸和10.00 mL 1.000 mol⋅L
-1的

溶液,充分反应后,用0.100 mol⋅L
-1 
标准溶液滴定过量的

,到达滴定终点时消耗

标准溶液16.00 mL。计算

样品的纯度并写出计算过程
_________。实验中发生反应的离子方程式为:

(未配平);

(未配平)。



