解答题-原理综合题 较难0.4 引用2 组卷315
CO2资源化利用受到越来越多的关注,它能有效减少碳排放,有效应对全球的气候变化,并且能充分利用碳资源。二氧化碳催化加氢制甲醇有利于减少温室气体排放,涉及的反应如下:
I.


II.
 kJ⋅mol-1
kJ⋅mol-1 
III.
 kJ⋅mol-1
kJ⋅mol-1 
回答下列问题:
(1)CO2分子的空间结构为___________ 形。
(2)
___________ kJ⋅mol-1。
(3)平衡常数
___________ (用 、
、 表示)。
表示)。
(4)为提高反应Ⅲ中 的平衡产率,应选择的反应条件为___________(填标号)。
的平衡产率,应选择的反应条件为___________(填标号)。
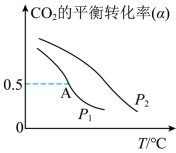
(5)不同压强下,按照 投料,发生反应I,实验测得
投料,发生反应I,实验测得 的平衡转化率随温度的变化关系如下图所示。
的平衡转化率随温度的变化关系如下图所示。 、
、 由大到小的顺序为
由大到小的顺序为___________ ,判断的依据是___________ 。
②图中A点对应的甲醇的体积分数是___________ %(计算结果保留1位小数)。
(6)在恒温恒压(压强为p)的某密闭容器中,充入1mol 和3mol
和3mol ,仅发生反应I和II,经过一段时间后,反应I和II达到平衡,此时测得
,仅发生反应I和II,经过一段时间后,反应I和II达到平衡,此时测得 的平衡转化率为20%,甲醇的选择性为50%{甲醇选择性[
的平衡转化率为20%,甲醇的选择性为50%{甲醇选择性[ ]},则该温度下反应I的平衡常数
]},则该温度下反应I的平衡常数
___________ (写出计算式即可,分压=总压×物质的量分数)。
I.
II.
III.
回答下列问题:
(1)CO2分子的空间结构为
(2)
(3)平衡常数
(4)为提高反应Ⅲ中
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
②图中A点对应的甲醇的体积分数是
(6)在恒温恒压(压强为p)的某密闭容器中,充入1mol
2024·黑龙江·模拟预测
类题推荐
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH1=-49.5kJ·mol-1
CH3OH(g)+H2O(g)ΔH1=-49.5kJ·mol-1
Ⅱ.CO(g)+2H2(g) CH3OH(g)ΔH2=-90.4kJ·mol-1
CH3OH(g)ΔH2=-90.4kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)ΔH3=___ kJ·mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为xmol,CO为ymol,此时H2O(g)的浓度为___ mol·L-1(用含x、y、V的代数式表示,下同),反应Ⅲ的平衡常数为___ 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

已知:CO2的平衡转化率= ×100%
×100%
CH3OH的平衡产率= ×100%
×100%
①其中纵坐标表示CO2平衡转化率的是图___ (填“甲”或“乙”)。
②压强p1、p2、p3由大到小的顺序为___ 。
③图乙中T1温度时,三条曲线几乎交于一点的原因是___ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___ (填标号)。
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为p0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为x,则容器的压强与起始压强之比为___ (用x表示)。
②若经过30h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为___ (保留三位有效数字)。
③平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数.写出上述反应压力平衡常数Kp为___ (用p0表示,并化简)。
Ⅰ.CO2(g)+3H2(g)
Ⅱ.CO(g)+2H2(g)
Ⅲ.CO2(g)+H2(g)
回答下列问题:
(1)ΔH3=
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为xmol,CO为ymol,此时H2O(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

已知:CO2的平衡转化率=
CH3OH的平衡产率=
①其中纵坐标表示CO2平衡转化率的是图
②压强p1、p2、p3由大到小的顺序为
③图乙中T1温度时,三条曲线几乎交于一点的原因是
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
①充分反应达到平衡后,若CO2转化率为x,则容器的压强与起始压强之比为
②若经过30h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为
③平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数.写出上述反应压力平衡常数Kp为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网






