解答题-实验探究题 适中0.65 引用2 组卷72
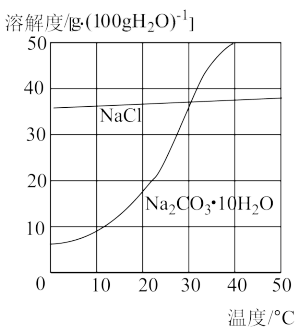
食盐和纯碱都是重要的化工原料,位于内蒙古中南部的达来诺尔湖中含有丰富的食盐和纯碱。夏天,将湖水引入湖滩上晒出食盐;冬天,湖面上会漂浮着大量的纯碱晶体( ),可以直接从湖中捞碱。
),可以直接从湖中捞碱。
Ⅰ.化学原理分析
(1)冬天“捞碱”的化学原理属于降温结晶,夏天“晒盐”的化学原理属于________ 。
(2)“捞碱”所得纯碱晶体中往往混有 ,检验
,检验 是否存在时,使用的试剂是
是否存在时,使用的试剂是________ (填化学式)。
Ⅱ.纯碱样品(含 杂质)中
杂质)中 质量分数的测定
质量分数的测定
第一步:称取质量为w g的样品,置于广口瓶中。
第二步:量取 溶液于分液漏斗中,与样品完全反应生成二氧化碳。
溶液于分液漏斗中,与样品完全反应生成二氧化碳。 溶液需用质量分数为98%、密度为
溶液需用质量分数为98%、密度为 的浓硫酸进行配制。
的浓硫酸进行配制。
(3)通过计算,需量取浓硫酸的体积为________ mL。下图中已列出实验过程需使用的部分仪器,还缺少的实验仪器有________ (填名称)。

(4)某同学配制溶液的过程如下:
①在烧杯中稀释浓硫酸,待溶液冷却至室温后,转移至容量瓶中
②……
③将蒸馏水缓慢注入容量瓶,直到液面接近刻度线1~2cm处
④……
⑤将容量瓶盖好,颠倒摇匀,装入试剂瓶
步骤④的操作为_____________________
(5)若该同学所配的硫酸浓度偏低,可能的原因是______ (填标号)。
a.移液前容量瓶中有少量水
b.洗涤量筒,并将洗涤液转移至容量瓶中
c.定容时俯视液面
d.摇匀后发现液面低于刻度线,补加少量水
第三步:按图示装置进行实验。

(6)经实验测得A装置质量变化量为a g,则样品中纯碱晶体( )的质量分数为
)的质量分数为________ ×100%(用含w、a的代数式表示)。
Ⅰ.化学原理分析
(1)冬天“捞碱”的化学原理属于降温结晶,夏天“晒盐”的化学原理属于
(2)“捞碱”所得纯碱晶体中往往混有
Ⅱ.纯碱样品(含
第一步:称取质量为w g的样品,置于广口瓶中。
第二步:量取
(3)通过计算,需量取浓硫酸的体积为

(4)某同学配制溶液的过程如下:
①在烧杯中稀释浓硫酸,待溶液冷却至室温后,转移至容量瓶中
②……
③将蒸馏水缓慢注入容量瓶,直到液面接近刻度线1~2cm处
④……
⑤将容量瓶盖好,颠倒摇匀,装入试剂瓶
步骤④的操作为
(5)若该同学所配的硫酸浓度偏低,可能的原因是
a.移液前容量瓶中有少量水
b.洗涤量筒,并将洗涤液转移至容量瓶中
c.定容时俯视液面
d.摇匀后发现液面低于刻度线,补加少量水
第三步:按图示装置进行实验。

(6)经实验测得A装置质量变化量为a g,则样品中纯碱晶体(
23-24高一上·山东滨州·期末
类题推荐
Ⅰ.我国青海省的茶卡盐湖不仅风景优美,也是西北著名的盐湖之一,夏天,人们将湖水引入湖滩上晒出食盐。冬天,湖面上漂浮着大量的纯碱晶体( ),人们可以直接从湖中捞碱。氯化钠和纯碱晶体的溶解度情况如下表所示:
),人们可以直接从湖中捞碱。氯化钠和纯碱晶体的溶解度情况如下表所示:
(1)“冬天捞碱”的原理相当于实验室中的降温结晶法,“夏天晒盐”的原理相当于实验室中的_______ 法。
(2)为检验纯碱样品中是否含有NaCl,应使用的试剂是_______。
Ⅱ.为测定纯碱样品(含NaCl杂质)的质量分数 ,某同学先将样品配成溶液,通过实验测定溶液浓度,最后求出样品中纯碱晶体的质量分数。
,某同学先将样品配成溶液,通过实验测定溶液浓度,最后求出样品中纯碱晶体的质量分数。
(3)实验过程中使用到下列仪器,其中使用前必须检查是否漏水的有_______。
(4)①第一步:配制100 mL样品溶液。
该同学配制溶液的部分过程如下,请写出中间步骤B的具体内容。_______
A.将蒸馏水缓慢注入容量瓶,直到液面接近刻度线l~2cm处。
B……
C.将容量瓶盖好,颠倒摇匀。
将溶液转移至容量瓶时用到了玻璃棒,其作用是_______ 。
②第二步:测定溶液浓度。
该同学量取样品溶液20.00 mL,与0.160 mol·L-1稀盐酸反应至完全转化为 ,消耗盐酸18.00 mL,写出该反应的离子方程式
,消耗盐酸18.00 mL,写出该反应的离子方程式_______ ,通过实验,测出 溶液的物质的量浓度为
溶液的物质的量浓度为_______ mol·L-1。
③第三步:求算样品中纯碱晶体的质量分数。
根据实验数据,欲求算纯碱晶体( )的质量分数,还需要通过称量得到的物理量是
)的质量分数,还需要通过称量得到的物理量是_______ 。
④通过计算,该同学得出的实验结果偏高,可能的原因是_______ 。
A.未用蒸馏水洗涤烧杯内壁
B.容量瓶中原有少量水
C.摇匀后发现液面低于刻度线,补加少量水
D.定容时俯视液面
温度 溶解度/s 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 35.9 | 36.1 | 36.4 |
| 7.3 | 13.6 | 24.9 | 52.9 | 70.8 |
(2)为检验纯碱样品中是否含有NaCl,应使用的试剂是_______。
| A. | B.稀盐酸、 |
| C.稀 | D.稀 |
Ⅱ.为测定纯碱样品(含NaCl杂质)的质量分数
(3)实验过程中使用到下列仪器,其中使用前必须检查是否漏水的有_______。
A.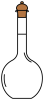 | B.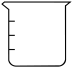 | C. | D. |
该同学配制溶液的部分过程如下,请写出中间步骤B的具体内容。
A.将蒸馏水缓慢注入容量瓶,直到液面接近刻度线l~2cm处。
B……
C.将容量瓶盖好,颠倒摇匀。
将溶液转移至容量瓶时用到了玻璃棒,其作用是
②第二步:测定溶液浓度。
该同学量取样品溶液20.00 mL,与0.160 mol·L-1稀盐酸反应至完全转化为
③第三步:求算样品中纯碱晶体的质量分数。
根据实验数据,欲求算纯碱晶体(
④通过计算,该同学得出的实验结果偏高,可能的原因是
A.未用蒸馏水洗涤烧杯内壁
B.容量瓶中原有少量水
C.摇匀后发现液面低于刻度线,补加少量水
D.定容时俯视液面
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网