解答题-原理综合题 适中0.65 引用1 组卷55
神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。
相关物质的摩尔生成焓∆HfHm如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用∆HfHm表示。如N2H4(1)的摩尔生成焓:N2(g)+2H2(g)=N2H4(l) ∆HfHm =+165.8kJ/mol
①∆H1=___________ kJ/mol。
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是___________ 。
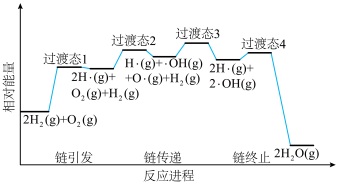
(2)火箭推进器内氢氧燃烧的简化反应历程如下图所示,分析其反应机理。
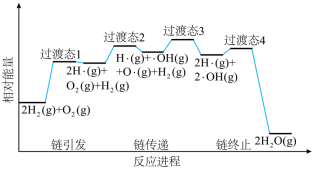
该历程分步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.在温度T下,容积固定的密闭容器中充入3 mol NO和2 mol H2发生2H2(g)+2NO(g) N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,
N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,
(3)则NO的平衡转化率α(NO)=___________ (结果保留三位有效数字),该反应的平衡常数Kp=___________ (用含P0的代数式表示)
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。
相关物质的摩尔生成焓∆HfHm如下表所示。
| 物质 | N2O4(g) | N2H4(l) | H2O(g) |
| 摩尔生成焓∆HfHm(kJ/mol) | +10.8 | +165.8. | -242.0 |
①∆H1=
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是
(2)火箭推进器内氢氧燃烧的简化反应历程如下图所示,分析其反应机理。

该历程分步进行,其中氢氧燃烧决速步对应的反应方程式为
Ⅱ.在温度T下,容积固定的密闭容器中充入3 mol NO和2 mol H2发生2H2(g)+2NO(g)
(3)则NO的平衡转化率α(NO)=
23-24高二上·宁夏石嘴山·期末
类题推荐
神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。相关物质的摩尔生成焓∆HfHm如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用∆HfHm表示。如N2H4(1)的摩尔生成焓:N2(g)+2H2(g)=N2H4(l) ∆HfHm =+165.8kJ/mol
①∆H1=___________ kJ/mol。
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是___________ 。
(2)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。___________ 步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1=+247 kJ/mol
b:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41kJ/mol
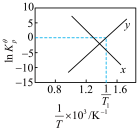
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力pΦ(pΦ=100kPa)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。___________ ,反应a的标准压强平衡常数表达式 =
=___________ 。
②维持T1温度下,往恒容密闭容器中通入等量CH4、CO2、H2O混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下CH4的平衡转化率为___________ ,H2的平衡分压为___________ (结果保留3位有效数字)kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
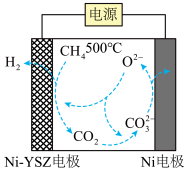
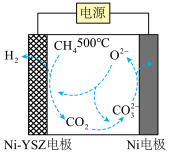
(4)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:___________ 。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。相关物质的摩尔生成焓∆HfHm如下表所示。
| 物质 | N2O4(g) | N2H4(l) | H2O(g) |
| 摩尔生成焓∆HfHm(kJ/mol) | +10.8 | +165.8. | -242.0 |
①∆H1=
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是
(2)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1=+247 kJ/mol
b:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41kJ/mol
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力pΦ(pΦ=100kPa)。反应a、b的ln随
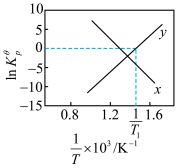
②维持T1温度下,往恒容密闭容器中通入等量CH4、CO2、H2O混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下CH4的平衡转化率为
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(4)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:
(一)完成下列问题
(1)在2L密闭容器中进行如下反应: ,在2s内用X表示的平均反应速率是
,在2s内用X表示的平均反应速率是 ,则2s时W增加的物质的量是_______
,则2s时W增加的物质的量是_______
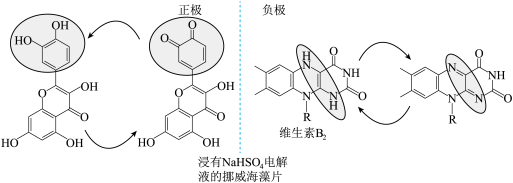
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素 为负极,从水果皮中提取的槲皮素为正极,
为负极,从水果皮中提取的槲皮素为正极, 水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[ ],发生反应:
],发生反应: ,达到平衡时压强为
,达到平衡时压强为 ,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断
,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断 与p的关系,并说明理由
与p的关系,并说明理由___________
___________
(4)以酚酞为指示剂,用0.1000 的NaOH溶液滴定20.00mL未知浓度的二元酸
的NaOH溶液滴定20.00mL未知浓度的二元酸 溶液。溶液中,pH、分布系数
溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
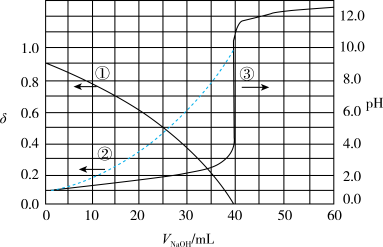
[比如 的分布系数:
的分布系数: ]知:常温下
]知:常温下 ,
, 。
。
下列叙述正确的是______
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼( )、液氢等,具有不同的推进效能。回答下列问题:
)、液氢等,具有不同的推进效能。回答下列问题:
(5)火箭推进剂可用 作燃料,
作燃料, 作氧化剂,反应的热化学方程式可表示为
作氧化剂,反应的热化学方程式可表示为

 。相关物质的摩尔生成焓
。相关物质的摩尔生成焓 如下表所示。
如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用 表示。如
表示。如 (l)的摩尔生成焓:
(l)的摩尔生成焓:

①
___________ kJ/mol。
②结合化学反应原理分析, (l)作推近剂燃料可与
(l)作推近剂燃料可与 (g)自发进行反应的原因是
(g)自发进行反应的原因是___________
___________ 。
(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
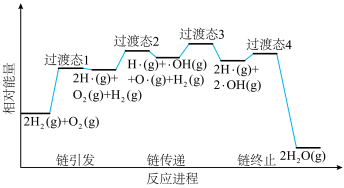
该历程分___________ 步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:

b:

已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力 (
( )。反应a、b的ln随
)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。
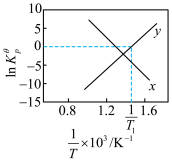
(7)①能表示反应b的曲线为___________ ,反应a的标准压强平衡常数表达式
___________ 。
②维持 温度下,往恒容密闭容器中通入等量
温度下,往恒容密闭容器中通入等量 、
、 、
、 混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下
混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下 的平衡转化率为
的平衡转化率为___________ , 的平衡分压为(结果保留3位有效数字)
的平衡分压为(结果保留3位有效数字)___________ kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:___________ 。
(1)在2L密闭容器中进行如下反应:
| A. | B. | C. | D. |
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素

| A.放电过程中海藻片中 |
B.放电时负极反应: -2e- -2e- +2H+ +2H+ |
C.充电时总反应: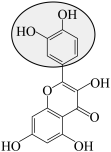 + +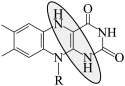 → →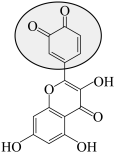 + +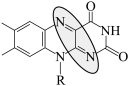 |
| D.该电池即使儿童误食也不会导致体内水电解而损害身体 |
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[
(4)以酚酞为指示剂,用0.1000

[比如
下列叙述正确的是______
| A.曲线①代表 |
| B. |
| C.滴定过程,pH=2时溶液中 |
| D.向 |
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(
(5)火箭推进剂可用
| 物质 | |||
| 摩尔生成焓 | +10.8 | +165.8 | -242.0 |
①
②结合化学反应原理分析,
(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。

该历程分
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:
b:
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力

(7)①能表示反应b的曲线为
②维持
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网