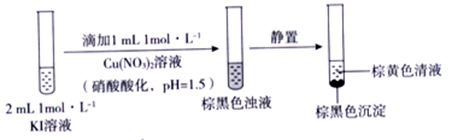
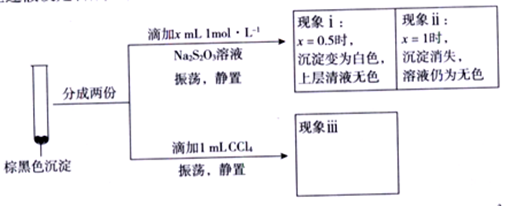
解答题-实验探究题 较难0.4 引用1 组卷77
某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。

(5)查阅资料已知:Fe3+、OH-、SO 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |  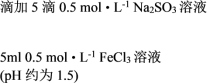 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |  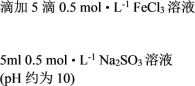 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入

(5)查阅资料已知:Fe3+、OH-、SO
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
23-24高二上·北京石景山·期末
类题推荐
某实验小组对FeCl3溶液与Na2SO3溶液的反应进行探究。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:__________ 。
【探究现象i产生的原因】
(2)甲同学认为发生反应:2Fe3++3 +6H2O
+6H2O 2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1mol/LNa2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1mol/LNa2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是_______ (填化学式)。
(3)乙同学认为还发生了氧化还原反应。他取少许红褐色溶液于试管中,加入______ ,有白色沉淀产生,证明产物中含有 。
。
丙同学认为乙同学的实验不严谨,因为在上述过程中 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。
【实验2】用如图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。
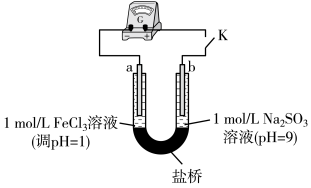
(4)实验2中正极的电极反应式为______ 。丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是___________ 。
【解释现象ii产生的原因】
(5)综合上述结果,请从平衡移动角度解释,现象ii产生的原因为___________________ 。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
| 装置 | 实验现象 |
 | 现象i:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ii:一段时间后溶液颜色变浅,变为浅黄色。 |
【探究现象i产生的原因】
(2)甲同学认为发生反应:2Fe3++3
(3)乙同学认为还发生了氧化还原反应。他取少许红褐色溶液于试管中,加入
丙同学认为乙同学的实验不严谨,因为在上述过程中
【实验2】用如图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。

(4)实验2中正极的电极反应式为
【解释现象ii产生的原因】
(5)综合上述结果,请从平衡移动角度解释,现象ii产生的原因为
某实验小组对FeCl3溶液与Na2SO3溶液的反应进行探究。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:_______ 。
(2)探究现象ⅰ产生的原因:
①甲同学认为发生反应:2Fe3++3S +6H2O
+6H2O 2Fe(OH)3(胶体)+3H2SO3;
2Fe(OH)3(胶体)+3H2SO3;
他取少量红褐色溶液于试管中,继续滴加1mol/L Na2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是_______ (填化学式)。
②乙同学认为还发生了氧化还原反应,其离子方程式为_______ ;他取少许红褐色溶液于试管中,加入_______ ,有白色沉淀产生,证明产物中含有 .
.
丙同学认为乙同学的实验不严谨,因为在上述过程中 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。
【实验2】
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。
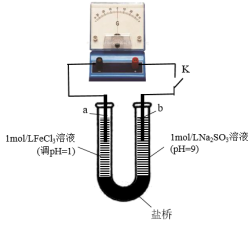
③实验2中正极的电极反应式为_______ 。丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是_______ 。
(3)解释现象ⅱ产生的原因:综合上述结果,请从平衡移动角度解释,现象ⅱ产生的原因为_______ 。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
| 装置 | 实验现象 |
 | 现象ⅰ:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ⅱ:一段时间后溶液颜色变浅,变为浅黄色。 |
(2)探究现象ⅰ产生的原因:
①甲同学认为发生反应:2Fe3++3S
他取少量红褐色溶液于试管中,继续滴加1mol/L Na2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
②乙同学认为还发生了氧化还原反应,其离子方程式为
丙同学认为乙同学的实验不严谨,因为在上述过程中
【实验2】
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。

③实验2中正极的电极反应式为
(3)解释现象ⅱ产生的原因:综合上述结果,请从平衡移动角度解释,现象ⅱ产生的原因为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网