解答题-实验探究题 适中0.65 引用2 组卷279
硼氢化钠 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下,请结合信息回答问题。
纯度的步骤如下,请结合信息回答问题。
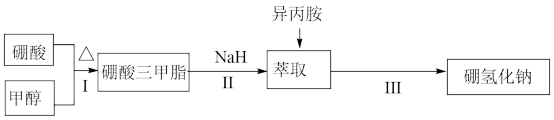
Ⅰ. 的制备
的制备
先打开 ,向装置中鼓入
,向装置中鼓入 ,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭
,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 。然后升温到240℃,持续搅拌下通入
。然后升温到240℃,持续搅拌下通入 ,打开
,打开 ,向三颈瓶中滴入硼酸三甲酯[分子式为
,向三颈瓶中滴入硼酸三甲酯[分子式为 ,沸点为68℃],充分反应后,降温后离心分离得到
,沸点为68℃],充分反应后,降温后离心分离得到 和
和 的固体混合物。
的固体混合物。
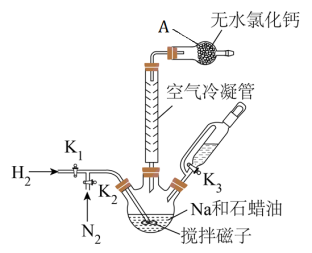
(1)仪器A的名称是__________ 。
(2)写出 与
与 的化学反应方程式
的化学反应方程式__________ 。
(3)将Na分散到石蜡油中的目的是__________ 。
Ⅱ. 的提纯
的提纯
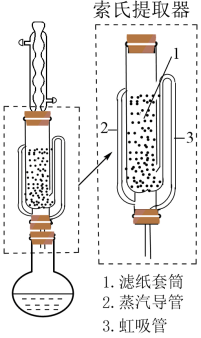
(4) 可采用索氏提取法提纯,其装置如图所示。实验时将
可采用索氏提取法提纯,其装置如图所示。实验时将 和
和 的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点:
的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点: ℃,沸点:33℃)受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管3返回烧瓶,从而实现连续萃取。当萃取完全后,
℃,沸点:33℃)受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管3返回烧瓶,从而实现连续萃取。当萃取完全后, 在
在__________ (填“圆底烧瓶”或“索氏提取器”)中。
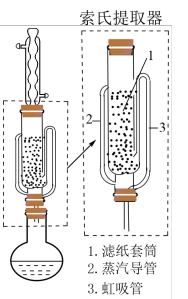
(5)分离异丙胺和 并回收溶剂的方法是
并回收溶剂的方法是__________ 。
Ⅲ. 的纯度分析[已知
的纯度分析[已知 ]
]
步骤1:取 产品(杂质不参与反应),将产品溶于X溶液后配成
产品(杂质不参与反应),将产品溶于X溶液后配成 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入 溶液充分反应。(反应为
溶液充分反应。(反应为 )
)
步骤2:向步骤1所得溶液中加入过量的KI溶液,用稀硫酸溶液调节pH,使过量 转化为
转化为 ,冷却后暗处放置数分钟。(反应为
,冷却后暗处放置数分钟。(反应为 )
)
步骤3:向步骤2所得溶液中加 和
和 缓冲溶液调pH约为5.0,加入几滴淀粉指示剂,用
缓冲溶液调pH约为5.0,加入几滴淀粉指示剂,用 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(反应为
。(反应为 )
)
(6)X溶液为__________ (写化学式)。
(7)产品中 的纯度为
的纯度为__________ %。
性质 | 固体,可溶于异丙胺或水,常温下与水缓慢反应,与酸剧烈反应,强碱环境下能稳定存在 | 固体,强还原性,与水剧烈反应产生 | 固体,难溶于异丙胺,常温下与水剧烈反应 |
先打开

(1)仪器A的名称是
(2)写出
(3)将Na分散到石蜡油中的目的是
Ⅱ.
(4)

(5)分离异丙胺和
Ⅲ.
步骤1:取
步骤2:向步骤1所得溶液中加入过量的KI溶液,用稀硫酸溶液调节pH,使过量
步骤3:向步骤2所得溶液中加
(6)X溶液为
(7)产品中
23-24高三上·辽宁沈阳·阶段练习
类题推荐
硼氢化钠 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下。
纯度的步骤如下。
Ⅰ. 的制备
的制备
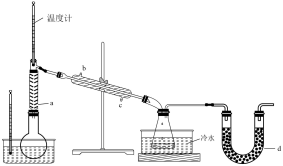
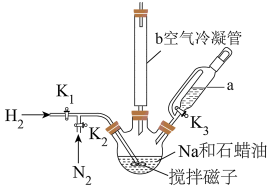
利用如图甲装置(加热及夹持装置略)进行操作: ,鼓入
,鼓入 ,升温到110℃,快速搅拌,将融化的Na快速分散到石蜡油中;
,升温到110℃,快速搅拌,将融化的Na快速分散到石蜡油中;
(ⅱ)升温到200℃,关闭 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 ;
;
(ⅲ)升温到240℃,持续搅拌下通入 ,打开
,打开 滴入硼酸三甲酯[分子式为
滴入硼酸三甲酯[分子式为 ];
];
(ⅳ)降温后,分离得到 和
和 的固体混合物。
的固体混合物。
已知:
 :可溶于异丙胺或水,常温下与水缓慢反应,强碱环境下能稳定存在
:可溶于异丙胺或水,常温下与水缓慢反应,强碱环境下能稳定存在
 :难溶于异丙胺
:难溶于异丙胺
异丙胺:有机溶剂,沸点:33℃
Ⅱ. 的提纯
的提纯
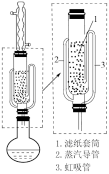
 可采用索氏提取法提纯,其装置如图乙所示,实验时将
可采用索氏提取法提纯,其装置如图乙所示,实验时将 和
和 的固体混合物放入滤纸套筒1中,烧瓶中加入异丙胺。烧瓶中异丙胺受热蒸发上升,冷凝后滴入滤纸套筒1中,再经导管返回烧瓶,从而实现连续萃取。
的固体混合物放入滤纸套筒1中,烧瓶中加入异丙胺。烧瓶中异丙胺受热蒸发上升,冷凝后滴入滤纸套筒1中,再经导管返回烧瓶,从而实现连续萃取。
步骤1:取m g产品(杂质不参加反应)溶于 溶液后配成
溶液后配成 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入 的
的 溶液充分反应。(
溶液充分反应。( )
)
步骤2:向步骤1反应后溶液中加入过量的KI溶液,用稀硫酸调节pH,使过量 转化为
转化为 ,冷却后于暗处放数分钟。
,冷却后于暗处放数分钟。
步骤3:将步骤2所得混合液调pH约为5.0,加入几滴淀粉,用 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液 。(
。( )
)
回答下列问题:
(1)仪器a的名称是__________ 。
(2)写出 与
与 反应的化学方程式
反应的化学方程式__________ 。
(3)下列有关说法不正确的是__________。
(4)按照先后顺序对本实验的滴定操作排序
检查是否漏水→蒸馏水洗涤→__________ →__________→a→__________→__________→__________。
a.加液至“0”刻度以上 处
处
b.调整液面至“0”刻度或“0”刻度下方,记录读数
c.倾斜转动滴定管,使标准液润湿滴定管内壁,将润洗液从下口排出
d.赶出尖嘴部分气泡
e.向碱式滴定管中加 标准液
标准液
f.向酸式滴定管中加 标准液
标准液
g.左手控制活塞(或挤压玻璃珠),右手振荡锥形瓶
h.左手振荡锥形瓶,右手控制活塞(或挤压玻璃珠)
(5)产品中 的纯度为
的纯度为__________ %。
Ⅰ.
利用如图甲装置(加热及夹持装置略)进行操作:
(ⅱ)升温到200℃,关闭
(ⅲ)升温到240℃,持续搅拌下通入
(ⅳ)降温后,分离得到
已知:
异丙胺:有机溶剂,沸点:33℃
Ⅱ.
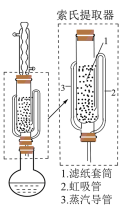
步骤1:取m g产品(杂质不参加反应)溶于
步骤2:向步骤1反应后溶液中加入过量的KI溶液,用稀硫酸调节pH,使过量
步骤3:将步骤2所得混合液调pH约为5.0,加入几滴淀粉,用
回答下列问题:
(1)仪器a的名称是
(2)写出
(3)下列有关说法不正确的是__________。
| A. | B.装置甲应该处于无水、无氧的反应环境 |
| C.装置乙中异丙胺蒸汽沿导管2上升 | D.萃取完全后, |
(4)按照先后顺序对本实验的滴定操作排序
检查是否漏水→蒸馏水洗涤→
a.加液至“0”刻度以上
b.调整液面至“0”刻度或“0”刻度下方,记录读数
c.倾斜转动滴定管,使标准液润湿滴定管内壁,将润洗液从下口排出
d.赶出尖嘴部分气泡
e.向碱式滴定管中加
f.向酸式滴定管中加
g.左手控制活塞(或挤压玻璃珠),右手振荡锥形瓶
h.左手振荡锥形瓶,右手控制活塞(或挤压玻璃珠)
(5)产品中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网