填空题 较难0.4 引用1 组卷141
含氯消毒剂会与水中有机物发生氯代反应,生成物会在人体内积留产生慢性累积中毒,诱发癌症,而 ClO2 是国际上公认的最理想的更换替代产品,我国从2000年起就逐渐用它取代了其它含氯消毒剂。市面上销售的二氧化氯消毒片都是二氧化氯的前体:亚氯酸钠,亚氯酸钠溶液与酸、有机物、还原剂或者氯供体接触,将会发生反应生成二氧化氯气体。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为___________ 。
(2)此反应中氧化剂与还原剂的物质的量之比为____ ,反应中盐酸的作用是____ (填编号)。
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为______ 。
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目______ ,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是______ 。
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是_______ 。
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式_________ 。
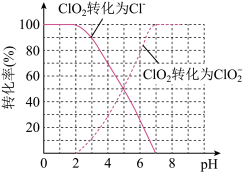
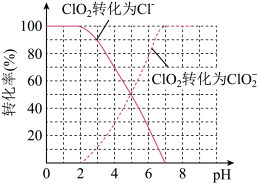
(7)饮用水中的ClO2、 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
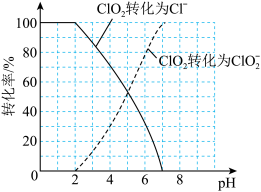
①请写出pH≤2.0时 与I-反应的离子方程式:
与I-反应的离子方程式:_________ 。
②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:_____ ,溶液再次显蓝色;
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中 的浓度为
的浓度为_______ mol/L(用含字母的代数式表示)。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为
(2)此反应中氧化剂与还原剂的物质的量之比为
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
| A.2NaSCN+MnO2+2H2SO4=Na2SO4+(SCN)2↑+MnSO4+2H2O |
| B.(CN)2+2KI=2KCN+I2 |
| C.Cl2+2NaOCN= (OCN)2+2NaCl |
| D.2AgCN=2Ag+(CN)2 |
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的
(7)饮用水中的ClO2、

①请写出pH≤2.0时
②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中
23-24高一上·上海·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网