解答题-原理综合题 适中0.65 引用1 组卷37
天然气的主要成分是CH4,是一种重要的燃料和化工原料,工业上可用天然气为原料制取一氧化碳和氢气。
(1)已知:①CH4(g)+ O2(g)⇌CO(g)+2H2O(g) K1 ∆H1=-519 kJ∙mol-1。
O2(g)⇌CO(g)+2H2O(g) K1 ∆H1=-519 kJ∙mol-1。
②H2(g)+ O2(g)⇌H2O(g) K2 ∆H2=-242 kJ∙mol-1
O2(g)⇌H2O(g) K2 ∆H2=-242 kJ∙mol-1
反应③CH4(g)+H2O(g)⇌CO(g)+3H2(g)的∆H3=___________ kJ∙mol-1,平衡常数K3=___________ (用K1、K2表示)。该反应在___________ (填“低温”、“高温”或“任何温度”)条件下自发进行。
(2)一定温度下,将2 mol CH4(g)与2 mol H2O(g)置于2 L密闭容器中发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
①下列可判断反应达到平衡状态的是___________ (填字母)。
A.混合气体的平均相对分子质量不变 B.混合气体的密度保持不变
C.CH4和H2O的物质的量之比保持不变 D.v正(H2O)=3v逆(H2)
②若该反应初始混合气中的n(H2O)/n(CH4)恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
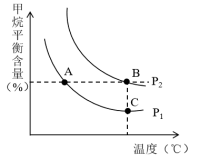
图中两条曲线表示的压强的关系是:P1___________ P2(填“>”“=”或“<”)。图中A、B、C三点平衡常数KA、KB、KC的大小关系是___________ 。
③某学习小组的同学模拟其原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。
分析表中数据,判断5 min时反应是否处于平衡状态___________ (填“是”或“否”),前5 min反应的平均反应速率
___________  。
。
(1)已知:①CH4(g)+
②H2(g)+
反应③CH4(g)+H2O(g)⇌CO(g)+3H2(g)的∆H3=
(2)一定温度下,将2 mol CH4(g)与2 mol H2O(g)置于2 L密闭容器中发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
①下列可判断反应达到平衡状态的是
A.混合气体的平均相对分子质量不变 B.混合气体的密度保持不变
C.CH4和H2O的物质的量之比保持不变 D.v正(H2O)=3v逆(H2)
②若该反应初始混合气中的n(H2O)/n(CH4)恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:

图中两条曲线表示的压强的关系是:P1
③某学习小组的同学模拟其原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | 0.20 | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
23-24高二上·四川南充·阶段练习
类题推荐
氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g) 2NH3(g)。该可逆反应达到平衡的标志是_____(填字母)。
2NH3(g)。该可逆反应达到平衡的标志是_____(填字母)。
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,在体积为2L的恒容密闭容器中测得如下表所示数据:
①分析表中数据,判断5min时反应_____ (填“是”或“不是”)处于平衡状态,前5min内,反应的平均反应速率v(CH4)=_____ ;
②反应在7~10min内,CO的物质的量减少的原因可能是_____ (填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
(3)氨的催化氧化:4NH3+5O2(g) 4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的ΔH
4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的ΔH_____ 0(填“>”“<”或“=”);T0℃下,NH3的转化率为_____ 。
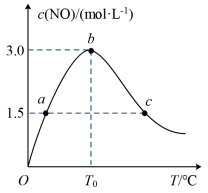
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)
| A.3v正(H2)=2v逆(NH3) |
| B.单位时间内生成mmolN2的同时生成3mmolH2 |
| C.容器内的总压强不再随时间变化 |
| D.混合气体的密度不再随时间变化 |
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,在体积为2L的恒容密闭容器中测得如下表所示数据:
| 时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
②反应在7~10min内,CO的物质的量减少的原因可能是
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
(3)氨的催化氧化:4NH3+5O2(g)
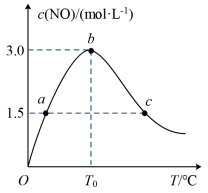
氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g) ⇌2NH3(g)。该可逆反应达到平衡的标志是________ 。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如表所示数据。请回答下列问题:
①分析表中数据,判断5 min时反应是否处于平衡状态?______ (填“是”或“否”),前5 min反应的平均反应速率v(CH4)=______ 。
②反应在7~10 min内,CO的物质的量减少的原因可能是________ 。
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
(3)氨的催化氧化:4NH3+5O2(g) ⇌4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1 L密闭容器中充入4 mol NH3(g)和5 mol O2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的ΔH________ (填“>”“<”或“=”)0。
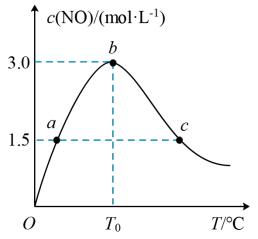
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g) ⇌2NH3(g)。该可逆反应达到平衡的标志是
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如表所示数据。请回答下列问题:
| 时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
②反应在7~10 min内,CO的物质的量减少的原因可能是
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
(3)氨的催化氧化:4NH3+5O2(g) ⇌4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1 L密闭容器中充入4 mol NH3(g)和5 mol O2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的ΔH
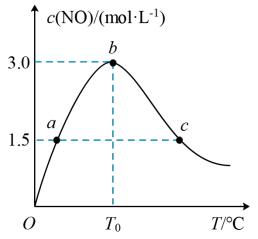
氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g) 2NH3(g)。该可逆反应达到平衡的标志是
2NH3(g)。该可逆反应达到平衡的标志是____ (填字母)。
(2)工业上可用天然气为原料来制取氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,在体积为2L的恒容密闭容器中测得如表所示数据:
①分析表中数据,判断5min时反应____ (填“是”或“不是”)处于平衡状态,前5min内,反应的平均反应速率v(CH4)=____ 。
②反应在7~10min内,CO的物质的量减少的原因可能是____ (填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
(3)氨的催化氧化:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的△H
4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的△H_____ 0(填“>”“<”或“=”);T0℃-T℃时该平衡是否向逆反应方向移动____ (填“是”或“否”)。
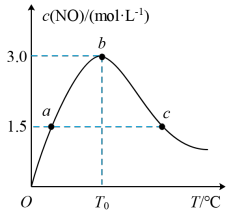
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)
| A.混合气体的物质的量不再随时间变化 |
| B.混合气体的质量不再随时间变化 |
| C.混合气体的颜色不再随时间变化 |
| D.混合气体的密度不再随时间变化 |
| 时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 |
①分析表中数据,判断5min时反应
②反应在7~10min内,CO的物质的量减少的原因可能是
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
(3)氨的催化氧化:4NH3(g)+5O2(g)
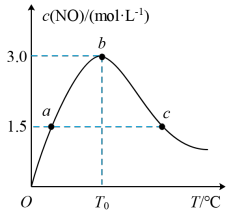
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


