解答题-实验探究题 较难0.4 引用1 组卷248
碱式次氯酸镁[化学式为Mg2ClO(OH)3·H2O]是一种白色粉末,难溶于水,也是新一代无机抗菌剂。可由Cl2、NaOH及MgCl2为原料制取。
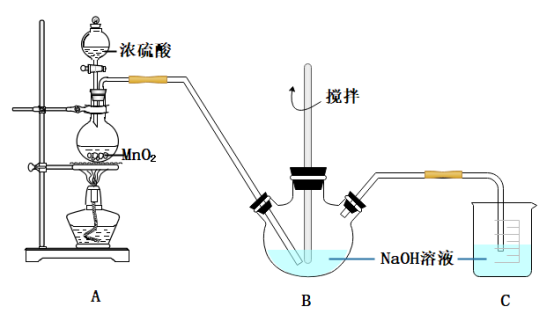
(1)甲同学拟利用如图装置制备质量分数约为5%的次氯酸钠溶液。
①B装置中饱和食盐水的作用为___________ 。
②Cl2和NaOH在较高的温度下反应生成NaClO3,写出该反应的离子反应方程式___________ ,因此控制反应在0~5℃范围内进行,实验中适宜的措施是___________ 。
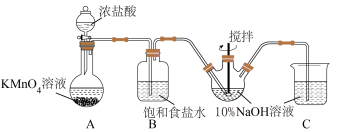
(2)乙同学拟利用甲同学制得的NaClO溶液制取碱式次氯酸镁,步骤如下:
步骤1:往烧瓶中加入氯化镁,开动搅拌器并升温到80℃;
步骤2:逐滴滴入NaClO溶液;
步骤3:调节溶液pH=10,回流反应4h;
步骤4:过滤,烘干。
①上图中,冷凝水从仪器A___________ (填"上口"或“下口"”) 进入。
②过滤时,需用到的玻璃仪器除烧杯外,还需___________ 。
③写出MgCl2、NaOH、Cl2反应制取Mg2ClO(OH)3·H2O的化学方程式:___________ 。
④通过测定Mg2ClO(OH)3·H2O产品有效氯的含量来衡量产品品质。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量= ×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2
×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2 =2I-+
=2I-+ )恰好完全反应,测得有效氯含量为
)恰好完全反应,测得有效氯含量为___________ 。(写出计算过程)
(1)甲同学拟利用如图装置制备质量分数约为5%的次氯酸钠溶液。

①B装置中饱和食盐水的作用为
②Cl2和NaOH在较高的温度下反应生成NaClO3,写出该反应的离子反应方程式
(2)乙同学拟利用甲同学制得的NaClO溶液制取碱式次氯酸镁,步骤如下:

步骤1:往烧瓶中加入氯化镁,开动搅拌器并升温到80℃;
步骤2:逐滴滴入NaClO溶液;
步骤3:调节溶液pH=10,回流反应4h;
步骤4:过滤,烘干。
①上图中,冷凝水从仪器A
②过滤时,需用到的玻璃仪器除烧杯外,还需
③写出MgCl2、NaOH、Cl2反应制取Mg2ClO(OH)3·H2O的化学方程式:
④通过测定Mg2ClO(OH)3·H2O产品有效氯的含量来衡量产品品质。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量=
23-24高一上·江苏镇江·期末
类题推荐
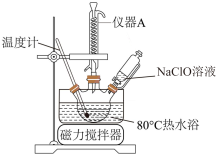
某实验小组制备无机抗菌剂:碱式次氯酸镁[Mg2ClO(OH)3·H2O,简称BMH],BMH难溶于水。用下图所示装置制备BMH。三颈烧瓶中盛有n(NaClO):n(MgCl2)为1:1.5的混合溶液,控制pH=10下恒温反应4小时。

请回答:
(1)仪器A的名称是_______ ,MgCl2的电子式为:_______ 。
(2)有关制备过程的下列说法,正确的是_______(填序号)。
(3)就抗菌和杀菌效果而言,氯制剂具有广谱、高效的特点,像BMH这样难溶又稳定的氯制剂几乎别无他物。在酸性溶液中BMH具有杀菌、漂白作用的原因是_______ (用离子方程式表示)
(4)反应结束后,为分离得到较纯净的BMH固体,将三颈烧瓶中混合物倒入烧杯,弃去清液→洗涤→干燥。下列操作中正确的洗涤步骤顺序为:_______ (填选项)
①加少量冷水②将玻璃棒放在烧杯上③搅拌④将清液沿玻璃棒倒入另一个容器⑤静置
A.①③②⑤④ B.③⑤①②④ C.①⑤③②④
(5)通过测定碱式次氯酸镁产品有效氯的含量来衡量产品质量。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量= 。Mg2ClO(OH)3·H2O有效氯的理论含量为42.14%。
。Mg2ClO(OH)3·H2O有效氯的理论含量为42.14%。
①实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和适量稀H2SO4(ClO-+2I-+2H+=I2+Cl-+H2O)。滴入20.00mL1mol·L-1Na2S2O3溶液(I2+2 =2I-+
=2I-+ )恰好完全反应。测得有效氯含量为
)恰好完全反应。测得有效氯含量为_______ 。
②实测值低于理论值,根据实验推测,样品中可能含有_______ 杂质。

请回答:
(1)仪器A的名称是
(2)有关制备过程的下列说法,正确的是_______(填序号)。
| A.滴液漏斗的支管有利于NaOH溶液顺利流下,防止爆炸 |
| B.装置中仪器A的作用是冷凝回流 |
| C.缓慢滴加NaOH溶液仅仅是为了控制反应温度 |
| D.pH不超过10,有利于降低产品中杂质的含量 |
(4)反应结束后,为分离得到较纯净的BMH固体,将三颈烧瓶中混合物倒入烧杯,弃去清液→洗涤→干燥。下列操作中正确的洗涤步骤顺序为:
①加少量冷水②将玻璃棒放在烧杯上③搅拌④将清液沿玻璃棒倒入另一个容器⑤静置
A.①③②⑤④ B.③⑤①②④ C.①⑤③②④
(5)通过测定碱式次氯酸镁产品有效氯的含量来衡量产品质量。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量=
①实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和适量稀H2SO4(ClO-+2I-+2H+=I2+Cl-+H2O)。滴入20.00mL1mol·L-1Na2S2O3溶液(I2+2
②实测值低于理论值,根据实验推测,样品中可能含有
碱式次氯酸镁(BMH),化学式为Mg2ClO(OH)3·H2O,白色粉末、难溶于水,常作消毒剂。某小组拟以海水为原料设计如下流程制备BMH:

请回答下列问题:
(1)回流反应中选择___________ (填“pH试纸”或“pH计”)测定反应液的pH。
(2)“烘干”可采用吹干、吸干等方式,不能采用“高温烘干”,原因是___________ 。
(3)利用下列装置制备NaClO溶液(已知:向0~5℃的烧碱溶液通入氯气生成NaClO, )。
)。

①C装置应采用___________ (填“冷水浴”或“热水浴”)。
②标出B装置盛装试剂并补全导管___________ 。
(4)回流反应中用氢氧化钠溶液调节pH,生成产品的离子方程式为___________ 。
(5)测定产品纯度。取mg产品溶于稀硫酸配成250mL溶液,取25.00mL配制的溶液于锥形瓶,加入足量KI溶液和适量稀硫酸,充分反应后,滴几滴淀粉溶液,用 溶液滴定(有关反应为
溶液滴定(有关反应为 ,
, ),测得三次平行实验消耗Na2S2O3,溶液体积如表所示:
),测得三次平行实验消耗Na2S2O3,溶液体积如表所示:
①滴定终点的现象是___________ 。
②该产品的纯度为___________ (用含m、c的代数式表示)。
(6)有效氯含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的质量来表示( ),有效氯含量
),有效氯含量 。理论上BMH的有效氯含重为
。理论上BMH的有效氯含重为___________ (计算结果保留一位小数)。

请回答下列问题:
(1)回流反应中选择
(2)“烘干”可采用吹干、吸干等方式,不能采用“高温烘干”,原因是
(3)利用下列装置制备NaClO溶液(已知:向0~5℃的烧碱溶液通入氯气生成NaClO,

①C装置应采用
②标出B装置盛装试剂并补全导管
(4)回流反应中用氢氧化钠溶液调节pH,生成产品的离子方程式为
(5)测定产品纯度。取mg产品溶于稀硫酸配成250mL溶液,取25.00mL配制的溶液于锥形瓶,加入足量KI溶液和适量稀硫酸,充分反应后,滴几滴淀粉溶液,用
| 实验 | 起始读数/mL | 终点读数/mL | 消耗Na2S2O3溶液体积/mL |
| Ⅰ | 0.20 | 21.40 | |
| Ⅱ | 1.10 | 20.90 | |
| Ⅲ | 2.00 | 22.20 |
②该产品的纯度为
(6)有效氯含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的质量来表示(
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网