解答题-原理综合题 适中0.65 引用1 组卷53
为了实现碳中和, 的处理成为各国科学家的研究重点。
的处理成为各国科学家的研究重点。
Ⅰ.将二氧化碳转化为绿色液体燃料甲醇,制备原理为 。已知某些化学键的键能数据如表所示。
。已知某些化学键的键能数据如表所示。
(1)当反应 生成
生成 时,
时,_____ (填“放出”或“吸收”)_____  能量。
能量。
(2)在体积为 的恒温、恒容密闭容器中,充入
的恒温、恒容密闭容器中,充入 和
和 进行反应
进行反应 (不考虑其他副反应)。
(不考虑其他副反应)。 时,测得
时,测得 和
和 的体积分数之比为
的体积分数之比为 且比值不再随时间变化。回答下列问题:
且比值不再随时间变化。回答下列问题:
①反应开始到平衡时,以 的浓度变化表示反应的平均速率v(H2)=
的浓度变化表示反应的平均速率v(H2)=_____  。
。
② 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
_____  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③该条件下反应达到平衡的标志有_____ (填字母)。
A. 和
和 的浓度之比为
的浓度之比为
B.断裂 键的同时生成
键的同时生成 键
键
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均摩尔质量保持不变
Ⅱ.用二氧化碳作原料设计 辅助
辅助 电池,电池反应产物为
电池,电池反应产物为 ,电池工作原理如图所示。正极的电极反应式为
,电池工作原理如图所示。正极的电极反应式为 、
、 。
。_____ (填“ ”或“多孔碳”)电极流出,电池的负极反应式为
”或“多孔碳”)电极流出,电池的负极反应式为_____ 。
Ⅰ.将二氧化碳转化为绿色液体燃料甲醇,制备原理为
| 化学键 | |||||
| 键能/( | 413.6 | 436.0 | 351.0 | 745.0 | 462.8 |
(1)当反应
(2)在体积为
①反应开始到平衡时,以
②
③该条件下反应达到平衡的标志有
A.
B.断裂
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均摩尔质量保持不变
Ⅱ.用二氧化碳作原料设计

22-23高二上·陕西咸阳·开学考试
类题推荐
研究二氧化碳的回收对我国2060年实现碳中和具有现实意义:
(1)已知:①
②
③
写出 与
与 反应生成
反应生成 和
和 的热化学方程式:。
的热化学方程式:。_______ 。
(2)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:
①通过表格中的数值可以推断:该反应的
_______ 0(填“>”、“<”、或“=”),其正反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行。
② 的平衡转化率与压强、温度及氢碳比
的平衡转化率与压强、温度及氢碳比 的关系分别如图a和图b所示。
的关系分别如图a和图b所示。
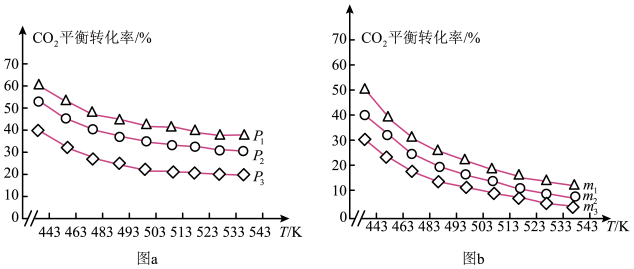
图a中压强从大到小的顺序为_______ ,图b中氢碳比m从大到小的顺序为_______ 。
(3)工业上也可以利用 和
和 合成甲醇:
合成甲醇: 某
某 恒温恒容密闭容器中充入
恒温恒容密闭容器中充入 和
和 发生反应,测得
发生反应,测得 和
和 浓度随时间变化如图所示:
浓度随时间变化如图所示:
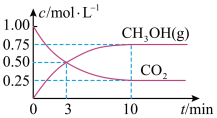
① 内,
内, 的平均反应速率为
的平均反应速率为_______  ,该温度下的平衡常数为
,该温度下的平衡常数为
_______ (单位可忽略)。若达平衡时,保持温度不变,向容器中再充入 和
和 各
各 ,则此时v正
,则此时v正_______ v逆(填“>”、“<”、或“=”)。
②下列说法能说明反应达到化学平衡状态的是_______ 。
A. 的消耗速率与
的消耗速率与 的消耗速率之比为3∶1
的消耗速率之比为3∶1
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D. 和
和 的浓度相等时
的浓度相等时
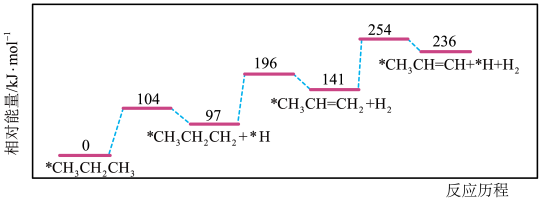
(4)丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法正确的是_______。
(1)已知:①
②
③
写出
(2)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:
| 温度/ | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
①通过表格中的数值可以推断:该反应的
②

图a中压强从大到小的顺序为
(3)工业上也可以利用

①
②下列说法能说明反应达到化学平衡状态的是
A.
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.
(4)丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法正确的是_______。

| A. |
| B.在该条件下,所得丙烯中不含其它有机物 |
| C.该过程中发生了碳碳键的断裂与形成 |
| D.相同条件下在该催化剂表面, |
用 合成燃料甲醇(
合成燃料甲醇( )是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2mol
)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2mol 和6mol
和6mol 发生反应:
发生反应: ,请回答下列问题:
,请回答下列问题:
(1)能判断该反应已达化学平衡状态的标志是___________(填字母)。
(2)现测得 和
和 的浓度随时间变化如图所示,回答下列问题:
的浓度随时间变化如图所示,回答下列问题:
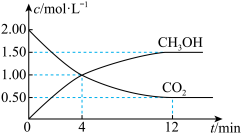
①从反应开始到平衡,氢气的平均反应速率
___________ 。
②平衡时甲醇的体积分数为___________ ,反应过程中 的最大转化率为
的最大转化率为___________ 。
(3)下图是以 为电解质溶液的甲醇燃料电池示意图:
为电解质溶液的甲醇燃料电池示意图: ,通入氧气的电极为燃料电池的
,通入氧气的电极为燃料电池的___________ 极(填“正”或“负”),其电极反应式为___________ ,随着电池工作,电解质溶液的 如何变化
如何变化___________ 。
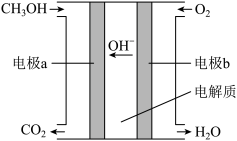
A.变大 B.变小 C.不变 D.无法判断
(1)能判断该反应已达化学平衡状态的标志是___________(填字母)。
| A.CO2百分含量保持不变 | B.容器中H2浓度与CO2浓度之比为3:1 |
| C.容器中混合气体的密度保持不变 | D.CO2的生成速率与CH3OH的生成速率相等 |
(2)现测得

①从反应开始到平衡,氢气的平均反应速率
②平衡时甲醇的体积分数为
(3)下图是以

A.变大 B.变小 C.不变 D.无法判断
绿色发展是必由之路,我国宣布二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。
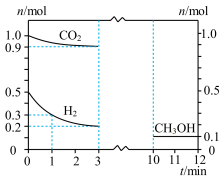
I.以 制备甲醇是实现“双碳”目标的重要途径。在体积为
制备甲醇是实现“双碳”目标的重要途径。在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,在
,在 、催化剂作用下反应得甲醇(沸点
、催化剂作用下反应得甲醇(沸点 )和物质X,测得各物质物质的量随时间的部分变化图如图:
)和物质X,测得各物质物质的量随时间的部分变化图如图: 和
和 制备甲醇的化学反应方程式为
制备甲醇的化学反应方程式为_______ 。
(2) 生产甲醇反应的原子利用率为
生产甲醇反应的原子利用率为_______ 。
(3) 内,甲醇的平均反应速率为
内,甲醇的平均反应速率为_______ (保留两位有效数字)。
Ⅱ. 与
与 制备合成气
制备合成气 ,该反应也是
,该反应也是 综合利用的研究热点之一。
综合利用的研究热点之一。
(4)已知:键能是指气态分子中 化学键解离成气态原子所吸收的馆量或气态原子形成
化学键解离成气态原子所吸收的馆量或气态原子形成 化学键所放出的能量。结合下表中化学键的键能数值,试计算合成反应中消耗
化学键所放出的能量。结合下表中化学键的键能数值,试计算合成反应中消耗 时
时_______ (填“吸收”或“放出”)的热量是_______  。
。
(5)恒容条件下,下列描述能证明该反应达到平衡的是_______(填字母)。
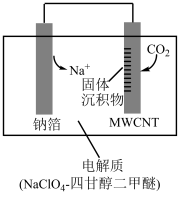
Ⅲ.利用“ ”电池将变废为宝。我国科研人员研制出可充电“
”电池将变废为宝。我国科研人员研制出可充电“ ”电池,以钠箔和多壁碳纳米管
”电池,以钠箔和多壁碳纳米管 为电极材放电料,总反应为:
为电极材放电料,总反应为: 。放电时,该电池会“吸入”,且生成的
。放电时,该电池会“吸入”,且生成的 和C全部沉积在电极表面。其工作原理如图所示。
和C全部沉积在电极表面。其工作原理如图所示。 在电池
在电池_______ 极(填“正”或“负”)被“吸入”。假设放电前两电极质量相等,当电路中转移 电子时,两极的质量差为
电子时,两极的质量差为_______ g。
I.以
(2)
(3)
Ⅱ.
(4)已知:键能是指气态分子中
| 化学键 | ||||
| 键能 | 413 | 745 | 436 | 1075 |
(5)恒容条件下,下列描述能证明该反应达到平衡的是_______(填字母)。
| A.容器中气体密度不再改变 | B. |
| C.断裂 | D. |
Ⅲ.利用“
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


