解答题-实验探究题 适中0.65 引用1 组卷73
用如图所示装置进行中和反应反应热的测定实验:
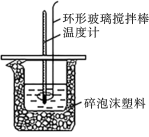
①用量筒量取50mL0.50mol⋅L-1盐酸倒入小烧杯,测出盐酸温度,用水将温度计上的酸冲洗干净,擦干备用;
②用另一量筒量取50mL0.55mol⋅L-1NaOH溶液,用温度计测出其温度;
③将NaOH溶液分多次缓慢倒入小烧杯,搅拌使之混合均匀,测得混合液的最高温度;
④重复测量2~3次,准确记录数据。
回答下列问题:
(1)上述步骤中有一处错误,请改正___________ 。
(2)___________ (填“能”或“不能”)用相同形状的细铁丝代替环形玻璃搅拌棒,理由是___________ 。
(3)假设盐酸和氢氧化钠溶液的密度都是1g⋅cm-3,又知中和反应后生成溶液的比热容 J⋅g-1⋅℃-1。某学生实验记录数据如表:
J⋅g-1⋅℃-1。某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和热
___________ kJ/mol(保留1位小数)。
(4)上述实验结果与中和热数值57.3kJ⋅mol-1有偏差,产生偏差的原因不可能为___________ (填字母)。
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
(5)若实验中改用60mL0.50mol⋅L-1盐酸与50mL0.55mol⋅L-1NaOH溶液进行反应,与上述实验相比,放出的热量________ (填“增多”、“减少”或“相等”,下同),所求得的中和热
_________ 。

①用量筒量取50mL0.50mol⋅L-1盐酸倒入小烧杯,测出盐酸温度,用水将温度计上的酸冲洗干净,擦干备用;
②用另一量筒量取50mL0.55mol⋅L-1NaOH溶液,用温度计测出其温度;
③将NaOH溶液分多次缓慢倒入小烧杯,搅拌使之混合均匀,测得混合液的最高温度;
④重复测量2~3次,准确记录数据。
回答下列问题:
(1)上述步骤中有一处错误,请改正
(2)
(3)假设盐酸和氢氧化钠溶液的密度都是1g⋅cm-3,又知中和反应后生成溶液的比热容
| 实验序号 | 起始温度 | 终止温度 | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(4)上述实验结果与中和热数值57.3kJ⋅mol-1有偏差,产生偏差的原因不可能为
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
(5)若实验中改用60mL0.50mol⋅L-1盐酸与50mL0.55mol⋅L-1NaOH溶液进行反应,与上述实验相比,放出的热量
22-23高二上·陕西咸阳·阶段练习
类题推荐
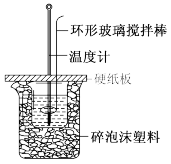
利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是___________ 。
(2)如图装置中碎泡沫塑料及泡沫碎料板的作用是___________ 。
(3)将NaOH溶液倒入小烧杯中的确操作为___________ 。
A.分多次倒入 B.一次倒入
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热|ΔH|=___________ (结果保留一位小数)。
(5)上述实验结果与理论值57.3 kJ/mol存在偏差,其原因可能是以下中的___________ 。
A.量完盐酸后未擦拭干净就量NaOH溶液的温度
B.量取盐酸溶液时仰视读数
C.读取最高温时错过最高值
(6)___________ (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是
(2)如图装置中碎泡沫塑料及泡沫碎料板的作用是
(3)将NaOH溶液倒入小烧杯中的确操作为
A.分多次倒入 B.一次倒入
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)上述实验结果与理论值57.3 kJ/mol存在偏差,其原因可能是以下中的
A.量完盐酸后未擦拭干净就量NaOH溶液的温度
B.量取盐酸溶液时仰视读数
C.读取最高温时错过最高值
(6)
利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.50 盐酸倒入内筒中,测出盐酸温度;
盐酸倒入内筒中,测出盐酸温度;
②用另一量筒量取50mL 0.55 NaOH溶液,并用同一温度计测出其温度;
NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入内筒中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是___________(填字母)。
(3)现将一定量的氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为___________ 。
(4)假设盐酸和氢氧化钠溶液的密度都是1 ,又知中和反应后生成溶液的比热容4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
,又知中和反应后生成溶液的比热容4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热
___________ (结果保留一位小数)。
(5)若计算生成1mol 时的放出的热量小于57.3kJ,产生偏差的原因可能是
时的放出的热量小于57.3kJ,产生偏差的原因可能是___________ (填字母)。
a.实验装置保温、隔热效果差
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
e.使用玻璃搅拌器搅拌不均匀
f.实验中用铜丝搅拌器代替玻璃搅拌器

①用量筒量取50mL 0.50
②用另一量筒量取50mL 0.55
③将NaOH溶液倒入内筒中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是___________(填字母)。
| A.用温度计小心搅拌 |
| B.揭开杯盖用玻璃棒搅拌 |
| C.轻轻地振荡烧杯 |
| D.用套在温度计上的玻璃搅拌器轻轻地搅动 |
(4)假设盐酸和氢氧化钠溶液的密度都是1
| 实验序号 | 起始温度 | 终止温度 | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.0 | 20.3 | 24.7 |
| 4 | 20.4 | 20.6 | 23.8 |
(5)若计算生成1mol
a.实验装置保温、隔热效果差
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
e.使用玻璃搅拌器搅拌不均匀
f.实验中用铜丝搅拌器代替玻璃搅拌器
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,用温度计测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温 度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)该同学每次分别取50 mL 0.50 mol·L-1 NaOH溶液和30 mL 0.50 mol·L -1硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是___________ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(3)现将一定量的氢氧化钠稀溶液、氢氧化钙稀溶液、稀氨水分别和1 L 1 mol·L-1稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___________ 。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·c ,又知中和反应后溶液的比热容c=4.18 J·
,又知中和反应后溶液的比热容c=4.18 J· ·
· 。为了计算中和热,某学生记录数据如下:
。为了计算中和热,某学生记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=___________ (结果保留一位小数)。
(5)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸的原因是___________ 。

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,用温度计测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温 度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)该同学每次分别取50 mL 0.50 mol·L-1 NaOH溶液和30 mL 0.50 mol·L -1硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(3)现将一定量的氢氧化钠稀溶液、氢氧化钙稀溶液、稀氨水分别和1 L 1 mol·L-1稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·c
| 实验序号 | 起始温度T1/ ℃ | 终止温度T2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸的原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


