填空题 较难0.4 引用2 组卷128
NaHCO3溶液不仅在受热时能分解放出CO2,而且在室温时亦能分解。
请回答下列问题:
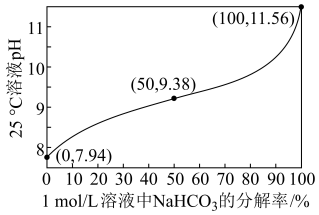
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。___________ 。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性___________ (填“强”或“弱”)。
③0.5 mol·L-1 Na2CO3溶液的pH=___________ 。
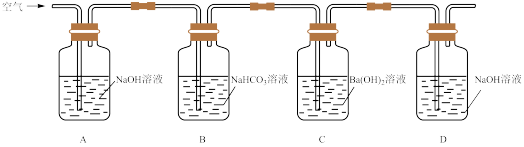
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。___________ 。
②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为___________ 。
③实验结果偏低的原因是___________ 。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性
③0.5 mol·L-1 Na2CO3溶液的pH=
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。

②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为
③实验结果偏低的原因是
22-23高一上·四川绵阳·期末
类题推荐
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______ 。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____ 。
③向NaCN溶液通入少量CO2反应的化学方程式是_______ 。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____ ,此时, =
=_____ 。
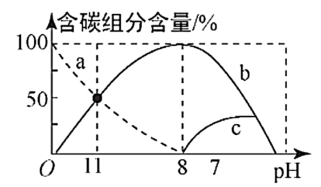
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
在同一溶液中H2CO3、 、
、
______ (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____ ,溶液中各种离子( 除外)的物质的量浓度的大小关系为
除外)的物质的量浓度的大小关系为______ 。
③已知在25℃时, 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh= =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c( ):c(
):c( )=2:1时,溶液pH=
)=2:1时,溶液pH=______ 。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________ mol/L。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)
③向NaCN溶液通入少量CO2反应的化学方程式是
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
在同一溶液中H2CO3、
②当pH=7时,溶液中含碳元素的主要微粒为
③已知在25℃时,
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网