解答题-实验探究题 适中0.65 引用1 组卷84
滴定法是化学上常用的定量分析的方法,有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
Ⅰ.常温下,用 溶液分别滴定
溶液分别滴定 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
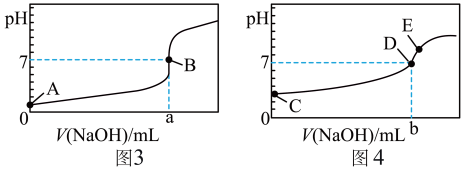
(1)中和滴定实验必须用到的仪器是___________。
(2)滴定醋酸的曲线是图___________ (填“3”或“4”),滴加2~3滴___________ 作指示剂(填“甲基橙”或“酚酞”)。
(3)如何判断图3对应的滴定终点:___________ 。
(4)达到B、D状态时,反应消耗 溶液的体积a___________b(填编号)。
溶液的体积a___________b(填编号)。
(5)A、B、C、E四点中,水的电离程度由大到小的顺序为:___________
E>___________>___________>___________。
Ⅱ.某 晶体中含有
晶体中含有 杂质,某同学在测定其
杂质,某同学在测定其 的含量时,称取
的含量时,称取 试样,配制成
试样,配制成 溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
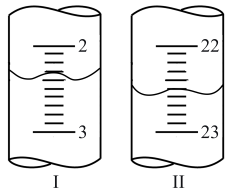
(6)①第二次滴定,从图Ⅰ到图Ⅱ,显示消耗的盐酸溶液体积为___________ mL。
②该实验测定 含量为
含量为
___________ 。(保留4位有效数字)
(7)若该同学测定结果偏大,则产生该误差的原因可能是__________。
(8)除滴定法外,还有很多定量方法可以测定 的含量,按照要求,参考范例,补全下列表格内容。
的含量,按照要求,参考范例,补全下列表格内容。
Ⅰ.常温下,用

(1)中和滴定实验必须用到的仪器是___________。
| A.胶头滴管 | B.玻璃棒 | C.滴定管 | D.容量瓶 |
(2)滴定醋酸的曲线是图
(3)如何判断图3对应的滴定终点:
(4)达到B、D状态时,反应消耗
| A.> | B.< | C.= | D.不确定 |
(5)A、B、C、E四点中,水的电离程度由大到小的顺序为:
E>___________>___________>___________。
Ⅱ.某
| 滴定次数 | 待测液(mL) | ||
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如下图Ⅰ | 如下图Ⅱ |

(6)①第二次滴定,从图Ⅰ到图Ⅱ,显示消耗的盐酸溶液体积为
②该实验测定
(7)若该同学测定结果偏大,则产生该误差的原因可能是__________。
| A.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色 |
| B.锥形瓶先用蒸馏水洗涤,再用待测液润洗,再加入待测溶液进行滴定 |
| C.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 |
| D.滴定管用蒸馏水洗涤后,直接注入待测液,取 |
(8)除滴定法外,还有很多定量方法可以测定
| 定量方法 | 实验原理(用方程式表示) | 已知物理量 | 直接测定的物理量 |
| (例)滴定法 | (例) | (例) | (例) |
| 室温、常压 | |||
| 重量法 | 相对原子质量 |
23-24高二上·上海·期末
类题推荐
化学是一门实验的科学,滴定法是化学上常用的定量分析的方法,有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:________ (填“1”或“2”),滴加2~3滴________ 作指示剂(填“甲基橙”或“酚酞”)。
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>________ 。
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
________ mL。
(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为 。
。
iii.终点时用去bmL 的KMnO4溶液。
的KMnO4溶液。
(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式___________ 。
(7)如何判定滴定终点___________ 。
(8)计算:血液中含钙离子的浓度为___________ mol/L(用字母表示)。
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中 为
为___________  (已知
(已知 )。
)。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
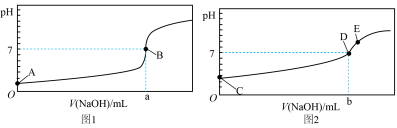
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
| A.> | B.< | C.= | D.不确定 |
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 1.02 | 18.97 |
| 2 | 20.00 | 0.60 | 见图 |
| 3 | 20.00 | 0.20 | 18.25 |

(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
| A.盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.配制标准溶液的固体NaOH中混有KOH杂质 |
| C.盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数 |
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵
ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为
iii.终点时用去bmL
(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式
(7)如何判定滴定终点
(8)计算:血液中含钙离子的浓度为
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中
联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下图:
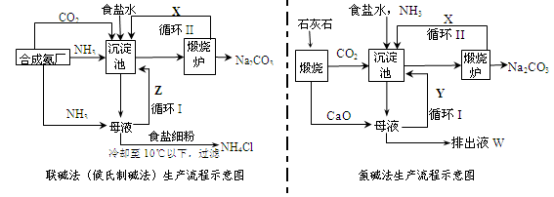
(1)两种方法的沉淀池中均发生的反应化学方程式为_____________________________ 。
(2)若沉淀池含800.00 mol NH3的水溶液质量为54.00 kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为______________ %。
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是______ 。
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确的是_______ (选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联碱法的另一项优点是__________________________________________________ 。
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
①第二次滴定,从图Ⅰ图Ⅱ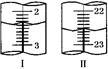 显示消耗的盐酸溶液体积为
显示消耗的盐酸溶液体积为_______________ 。
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)=__________________________ 。
③该同学测定结果有一定的误差,产生该误差的原因可能是________ (选填编号)。
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定

(1)两种方法的沉淀池中均发生的反应化学方程式为
(2)若沉淀池含800.00 mol NH3的水溶液质量为54.00 kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确的是
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联碱法的另一项优点是
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
①第二次滴定,从图Ⅰ图Ⅱ
 显示消耗的盐酸溶液体积为
显示消耗的盐酸溶液体积为②该实验测定NaHCO3含量的计算式为ω(NaHCO3)=
③该同学测定结果有一定的误差,产生该误差的原因可能是
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定
滴定是一种重要的定量实验方法。
Ⅰ.常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到如图1、2所示两条滴定曲线:
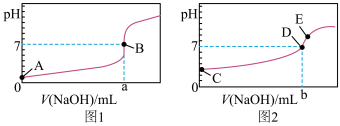
(1)滴定盐酸的曲线是图_________ (填“1”或“2”)。
(2)分别达到B、D状态时,反应消耗NaOH溶液的体积:a_________ b(填“>”、“<”或“=”)。
Ⅱ.为测定某品牌洗厕精(主要成分为盐酸)中盐酸的含量,某兴趣小组同学用已知物质的量浓度的NaOH溶液来测定该洗厕精中盐酸的物质的量浓度:取20.00mL洗厕精,并将其配制成100mL待测液:取25.00mL待测液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.100mol/LNaOH标准溶液进行滴定。
(3)NaOH标准溶液应盛装在_________ (填“酸式”或“碱式”)滴定管中。
(4)滴定达到终点的标志是_________ 。
(5)实验数据记录如下:
计算该洗厕精中盐酸的物质的量浓度
_________ mol/L。
(6)分析下列操作对所测洗厕精中盐酸的物质的量浓度的影响:(填“偏大”、“偏小”或“无影响”)
①读取NaOH标准溶液体积时,滴定前仰视读数,滴定结束后俯视读数_________ 。
②碱式滴定管在滴定前有气泡,滴定后气泡消失_________ 。
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁_________ 。
Ⅰ.常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到如图1、2所示两条滴定曲线:

(1)滴定盐酸的曲线是图
(2)分别达到B、D状态时,反应消耗NaOH溶液的体积:a
Ⅱ.为测定某品牌洗厕精(主要成分为盐酸)中盐酸的含量,某兴趣小组同学用已知物质的量浓度的NaOH溶液来测定该洗厕精中盐酸的物质的量浓度:取20.00mL洗厕精,并将其配制成100mL待测液:取25.00mL待测液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.100mol/LNaOH标准溶液进行滴定。
(3)NaOH标准溶液应盛装在
(4)滴定达到终点的标志是
(5)实验数据记录如下:
| 滴定次数 | 待测液的体积/mL | 0.100mol/LNaOH标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0 | 26.25 |
| 第二次 | 25.00 | 1.56 | 27.80 |
| 第三次 | 25.00 | 0.22 | 26.48 |
(6)分析下列操作对所测洗厕精中盐酸的物质的量浓度的影响:(填“偏大”、“偏小”或“无影响”)
①读取NaOH标准溶液体积时,滴定前仰视读数,滴定结束后俯视读数
②碱式滴定管在滴定前有气泡,滴定后气泡消失
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


