解答题-实验探究题 适中0.65 引用1 组卷36
回答下列问题。
I.25℃时Ka(CH3COOH)=1.8×10-5,测得0.1mol/LCH3COOH溶液的pH为2.88,0.01mol/LCH3COOH溶液的pH为x。
(1)CH3COOH的电离方程式是___________ 。
(2)x的值最有可能是以下选项中的___________。
(3)25℃时,向10mL0.10mol/LCH3COOH溶液中逐滴加入0.10mol/LNaOH溶液,当混合溶液中c(CH3COO-)=c(Na+)时,溶液的pH___________ 7(填>、<或=),此时所加NaOH溶液的体积___________ 10mL(填>、<或=)。
Ⅱ.实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的醋酸。
(4)用___________ 取待测醋酸溶液20.00mL于锥形瓶中,向其中滴加2滴___________ 作指示剂。滴定终点的现象:___________ 。
(5)进行了三次平行实验,将氢氧化钠标准溶液的体积读数记录如下:
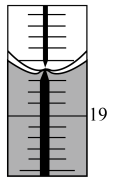
第3次实验的终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数为___________ mL。根据以上数据计算该样品中醋酸的浓度为___________ 。
I.25℃时Ka(CH3COOH)=1.8×10-5,测得0.1mol/LCH3COOH溶液的pH为2.88,0.01mol/LCH3COOH溶液的pH为x。
(1)CH3COOH的电离方程式是
(2)x的值最有可能是以下选项中的___________。
| A.1.88 | B.2.38 | C.3.38 | D.3.88 |
(3)25℃时,向10mL0.10mol/LCH3COOH溶液中逐滴加入0.10mol/LNaOH溶液,当混合溶液中c(CH3COO-)=c(Na+)时,溶液的pH
Ⅱ.实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的醋酸。
(4)用
(5)进行了三次平行实验,将氢氧化钠标准溶液的体积读数记录如下:
| 序号 | 初读数mL | 末读数mL |
| 1 | 1.40 | 19.80 |
| 2 | 2.20 | 20.70 |
| 3 | 0.00 |

第3次实验的终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数为
23-24高二上·上海奉贤·阶段练习
类题推荐
已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
Ⅰ、(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将该溶液加水稀释至1 000 mL,所得溶液pH数值范围为_______ ;若加入少量NaOH溶液,则溶液中
_______ (填“增大”“减小”“不变”或“不能确定”)。
(2)25 ℃时,0.1 mol·L-1的氨水的pH=_______ 。
(3)用pH试纸测定该氨水pH的操作方法为_______ 。
(4)pH相等的氨水和Na2CO3溶液中,水电离出的OH-浓度分别为a mol/L和b mol/L。则a_______ b(填“>”、“<”或“=”)。
Ⅱ、现用醋酸标准溶液来测定NaOH溶液的浓度。含以下实验操作:
①向溶液中加入1~2滴指示剂②取20.00 mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点④重复以上操作
⑤配制250 mL醋酸标准溶液⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是_______ (填序号),该滴定实验所选指示剂为_______ 。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积V(NaOH)=  mL=20.20 mL。他的计算
mL=20.20 mL。他的计算_______ (填“合理”或“不合理”),理由是_______ 。通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a_______ 20.02(填“>”、“<”或“=”)。

Ⅰ、(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将该溶液加水稀释至1 000 mL,所得溶液pH数值范围为
(2)25 ℃时,0.1 mol·L-1的氨水的pH=
(3)用pH试纸测定该氨水pH的操作方法为
(4)pH相等的氨水和Na2CO3溶液中,水电离出的OH-浓度分别为a mol/L和b mol/L。则a
Ⅱ、现用醋酸标准溶液来测定NaOH溶液的浓度。含以下实验操作:
①向溶液中加入1~2滴指示剂②取20.00 mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点④重复以上操作
⑤配制250 mL醋酸标准溶液⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(CH3COOH)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |

醋酸是一种常见的弱酸,回答下列问题:
(1)下列哪些措施能够使醋酸溶液中 增大___________。
增大___________。
(2)向100mL0.1mol·L-1的醋酸中加入VmL0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V___________ 100mL(填“>”,“<”或“=”)。
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中: =18,则此时溶液的pH=
=18,则此时溶液的pH=___________ 。(已知:CH3COOH的电离常数Ka=1.9×10-5)
(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用___________ 作指示剂。
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显少于后两次,其原因可能是___________ 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=___________ mol/L。
(1)下列哪些措施能够使醋酸溶液中
| A.升温 | B.通入HCl气体 | C.加入NaHSO4固体 | D.加入NaOH固体 |
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中:
(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 24.72 | 25.35 | 25.30 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=
(1)物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液的pH______ 7(选填“>”“<”或“=”,下同),所用醋酸体积______ 氢氧化钠溶液体积。
(2)亚磷酸(H3PO3)是二元弱酸,已知常温下H3PO3的电离常数的值:Ka1=3.7×10-2,Ka2=2.9×10-7。则NaH2PO3溶液显______ 性(选填“酸”“碱”或“中”)。
(3)某化学兴趣小组利用0.1mol/L的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。①已知亚磷酸(H3PO3)具有较强的还原性,能被酸性KMnO4溶液氧化为磷酸,且磷酸在水溶液中主要以分子形式存在,请写出该滴定反应的离子方程式:______ 。
②该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,用上述酸性KMnO4标准溶液进行滴定,三次滴定的测量数据如下:
则滴定终点的现象为:______ 。该亚磷酸溶液的物质的量浓度为______ mol/L。
(2)亚磷酸(H3PO3)是二元弱酸,已知常温下H3PO3的电离常数的值:Ka1=3.7×10-2,Ka2=2.9×10-7。则NaH2PO3溶液显
(3)某化学兴趣小组利用0.1mol/L的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。①已知亚磷酸(H3PO3)具有较强的还原性,能被酸性KMnO4溶液氧化为磷酸,且磷酸在水溶液中主要以分子形式存在,请写出该滴定反应的离子方程式:
②该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,用上述酸性KMnO4标准溶液进行滴定,三次滴定的测量数据如下:
| 实验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
则滴定终点的现象为:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


