解答题-原理综合题 适中0.65 引用1 组卷29
通过化学的方法实现 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径。
减排途径。
Ⅰ.利用酸性水溶液电解池在铂电极上捕集 制储氢物质
制储氢物质 。
。
(1) 被
被___________ (填“氧化”或“还原”)为 ,该铂电极为
,该铂电极为___________ 极。
(2)写出该铂电极的电极方程式___________ 。
(3)当电路中转移 电子时,理论上可生成
电子时,理论上可生成
___________ g。
Ⅱ.利用 制备CO
制备CO
一定温度下,在恒容密闭容器中投入一定量 和
和 进行反应:
进行反应:

(4)在恒定温度与容积下,可以提高 平衡转化率的措施有___________。
平衡转化率的措施有___________。
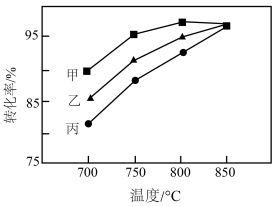
(5)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得氢气转化率随温度变化如图所示。下列说法错误的是___________。
(6)恒容密闭容器中发生上述反应,在投料比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度T(B)
平衡转化率如图所示。则B和D两点的温度T(B)___________ T(D)(填“<”、“>”或“=”),其原因是___________ 。

Ⅲ.利用制备甲醇
一定条件下,向恒容密闭容器中通入一定量和 ,实际可能发生以下两个反应:
,实际可能发生以下两个反应:
主反应:

副反应:

(7)其他条件相同,不同压强下,平衡时 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。

①压强
___________  (填“<”或“>”)。
(填“<”或“>”)。
②如图中温度高于 时,两条曲线重叠的原因是:
时,两条曲线重叠的原因是:___________ 。
Ⅰ.利用酸性水溶液电解池在铂电极上捕集
(1)
(2)写出该铂电极的电极方程式
(3)当电路中转移
Ⅱ.利用
一定温度下,在恒容密闭容器中投入一定量
(4)在恒定温度与容积下,可以提高
| A.向反应容器中充入 | B.向反应容器中充入 |
| C.添加更有效的催化剂 | D.利用合适试剂干燥混合气体 |
(5)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得氢气转化率随温度变化如图所示。下列说法错误的是___________。

| A.850℃下,该时间段内甲、乙、丙可能均达到平衡 |
| B.700℃下,甲对应的活化能最大 |
| C.一般催化剂既能降低活化能,又能降低过渡态的能量 |
| D.其它条件一定时,随着温度升高,单位体积内活化分子数占比增大 |
(6)恒容密闭容器中发生上述反应,在投料比

Ⅲ.利用制备甲醇
一定条件下,向恒容密闭容器中通入一定量和
主反应:
副反应:
(7)其他条件相同,不同压强下,平衡时

①压强
②如图中温度高于
23-24高二上·上海·阶段练习
类题推荐
CH3OH是重要的能源物质,CO2转化为甲醇是一种有效减少CO2排放的方法。
(1) 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ

反应Ⅲ

若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)向恒温2L容器中充入一定量 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
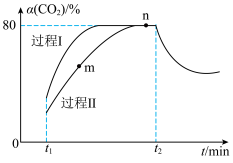
下列说法正确的是___________(填序号)。
(3)在25℃和 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
①压强从 到
到 ,平衡
,平衡___________ (填“正向”“逆向”或“不”)移动;
②压强从 到
到 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是___________ 。
(4)在温度 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,
___________  (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)
(5)温度为 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为___________ 。
反应Ⅰ
反应Ⅱ
反应Ⅲ
(1)
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ
反应Ⅲ
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A.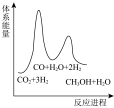 | B.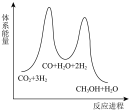 | C. | D. |
(2)向恒温2L容器中充入一定量

下列说法正确的是___________(填序号)。
| A.m点: |
| B. |
| C.活化能:过程Ⅱ<过程Ⅰ |
| D. |
(3)在25℃和
| 压强(Pa) | |||
| 浓度( | 0.08 | 0.20 | 0.44 |
②压强从
(4)在温度
(5)温度为
反应Ⅰ
反应Ⅱ
反应Ⅲ
丙烯是重要的化工原料,可用于生产丙醇、卤代烃和塑料。
(1)工业上用丙烯加成法制备1,2—二氯丙烷,主要副产物为3—氯丙烯, 反应原理为:
Ⅰ.CH2=CHCH3(g)+Cl2(g) CH2ClCHClCH3(g) △H1=—134 kJ/mol
CH2ClCHClCH3(g) △H1=—134 kJ/mol
Ⅱ.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) △H2=—102 kJ/mol
CH2=CHCH2Cl(g)+HCl(g) △H2=—102 kJ/mol
则CH2=CHCH2Cl(g)+HCl(g) CH2ClCHClCH3(g) △H3=
CH2ClCHClCH3(g) △H3=_______ kJ/mol
(2)某研究小组向密闭容器中充入一定量的CH2=CHCH3,分别在A、B两种不同便化利作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如下图所示。

下列说法错误的是_______(填代号)。
(3)C3H8(g)  C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为p1和p2时,测得丙烷及丙烯的物质的量分数如图所示。
C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为p1和p2时,测得丙烷及丙烯的物质的量分数如图所示。

①p1_______ p2(填“大于”、“小于”或“等于”)。
②起始时充入一定量丙烷,在恒压p1=0.2MPa条件下发生反应,Q点对应温度下丙烷的转化率为_______ (保留1位小数),该反应的平衡常数Kp=_______ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)下图是一个电化学过程的示意图:

①写出甲池中通入CH3OH一极的电极反应式:_______ 。
②丙池是体积为100 mL 含有如下离子的溶液:
电解一段时间后,当两极收集到相同条件下相同体积的气体时,阳板上收集到氧气的物质的量为_______ 。(忽略溶液体积的变化和气体产物的溶解)
(1)工业上用丙烯加成法制备1,2—二氯丙烷,主要副产物为3—氯丙烯, 反应原理为:
Ⅰ.CH2=CHCH3(g)+Cl2(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)
则CH2=CHCH2Cl(g)+HCl(g)
(2)某研究小组向密闭容器中充入一定量的CH2=CHCH3,分别在A、B两种不同便化利作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如下图所示。

下列说法错误的是_______(填代号)。
| A.使用催化剂A的最佳温度约为250℃ |
| B.相同条件下,改变压强不影响CH2ClCHClCH3的产率 |
| C.两种催化剂均能降低反应的活化能,但△H不变 |
| D.P点可能为对应温度下CH2ClCHClCH3的平衡产率 |

①p1
②起始时充入一定量丙烷,在恒压p1=0.2MPa条件下发生反应,Q点对应温度下丙烷的转化率为
(4)下图是一个电化学过程的示意图:

①写出甲池中通入CH3OH一极的电极反应式:
②丙池是体积为100 mL 含有如下离子的溶液:
| 离子 | Cu2+ | H+ | Cl— | |
| 浓度(mol/L) | 1.0 | 4.0 | 4.0 | 1.0 |
资源的可持续发展是化学家的重要研究方向。甲醇是优质的清洁燃料,可制作燃料电池。
(Ⅰ)CO2经催化加氢可生成甲醇,主要有以下两个反应:
反应①:CO2(g) + 3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH = –49.6kJ·mol-1
反应②:2CO2(g)+6H2(g) ⇌ CH3OCH3(g)+3H2O(g) ΔH = –122.5 kJ·mol-1
(1)反应①的活化能Ea(正)___________ Ea(逆)(填“>”“<”或“=”)。
(2)一定温度下,在某一恒容密闭容器中充入一定量的CO2和H2,发生反应①。下列能说明该反应已达到平衡状态的是___________(填序号)。
(3)在T温度下,将2.5mol CO2和5.5mol H2充入2L的恒容密闭容器中发生反应①和②,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1mol和0.25mol。则T温度时反应①的平衡常数K为___________ 。
(4)催化剂作用下,充入CO2和H2同时发生反应①和反应②,经相同反应时间,测得不同温度下CO2转化率和CH3OH产率的变化曲线如图。220℃~240℃温度区间CO2转化率和CH3OH产率的变化不一致的可能原因是___________ 。

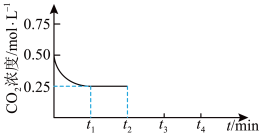
(5)向2L密闭容器中充入1mol CO2和3mol H2,在一定条件下,发生反应:CO2(g) + 3H2(g) ⇌ CH3OH(l) + H2O(l) ΔH <0。CO2的浓度随时间(0 ~ t2)变化如图所示。其他条件不变,在t2时间将容器体积缩小至原来的一半,t3时重新达到平衡。请画出t2 ~ t4时段内CO2浓度的变化曲线。___________ (在答题卷对应区域作图)
(Ⅱ)下图是一个电化学过程的示意图:

(6)图中甲池是___________ 装置(填“电解池”或“原电池”)。
(7)写出通入CH3OH一极的电极反应式:___________ 。
(8)乙池中总反应的离子方程式为___________ 。
(9)丙池是体积为 100mL含有如下离子的溶液:
电解一段时间后,当两极收集到相同条件下相同体积的气体时,阳极上收集到氧气的物质的量为___________ mol。(忽略溶液体积的变化和气体产物的溶解)
(Ⅰ)CO2经催化加氢可生成甲醇,主要有以下两个反应:
反应①:CO2(g) + 3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH = –49.6kJ·mol-1
反应②:2CO2(g)+6H2(g) ⇌ CH3OCH3(g)+3H2O(g) ΔH = –122.5 kJ·mol-1
(1)反应①的活化能Ea(正)
(2)一定温度下,在某一恒容密闭容器中充入一定量的CO2和H2,发生反应①。下列能说明该反应已达到平衡状态的是___________(填序号)。
| A.混合气体的密度不再随时间变化而改变 |
| B.气体的压强不再随时间变化而改变 |
| C.CH3OH的物质的量不再随时间变化而改变 |
| D.单位时间内每形成1.5mol H-H键,同时形成1mol C-H键 |
(4)催化剂作用下,充入CO2和H2同时发生反应①和反应②,经相同反应时间,测得不同温度下CO2转化率和CH3OH产率的变化曲线如图。220℃~240℃温度区间CO2转化率和CH3OH产率的变化不一致的可能原因是

(5)向2L密闭容器中充入1mol CO2和3mol H2,在一定条件下,发生反应:CO2(g) + 3H2(g) ⇌ CH3OH(l) + H2O(l) ΔH <0。CO2的浓度随时间(0 ~ t2)变化如图所示。其他条件不变,在t2时间将容器体积缩小至原来的一半,t3时重新达到平衡。请画出t2 ~ t4时段内CO2浓度的变化曲线。

(Ⅱ)下图是一个电化学过程的示意图:

(6)图中甲池是
(7)写出通入CH3OH一极的电极反应式:
(8)乙池中总反应的离子方程式为
(9)丙池是体积为 100mL含有如下离子的溶液:
| 离子 | Cu2+ | H+ | Cl- | SO |
| 浓度(mol·L-1) | 1.0 | 4.0 | 4.0 | 1.0 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


