解答题-原理综合题 较易0.85 引用1 组卷83
完成下列问题
(1)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。
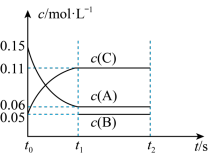
已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若 ,则
,则 内反应速率
内反应速率
_______ 。
②写出该反应的化学方程式:________ 。
(2)已知部分化学键的键能如表:
①已知生成1mol 放出46kJ热量,则
放出46kJ热量,则
____ 。
②已知工业合成氨反应 ,在恒温(200℃)、恒容条件下,下列描述能作为判断t时刻合成氨反应达到化学平衡状态的依据有
,在恒温(200℃)、恒容条件下,下列描述能作为判断t时刻合成氨反应达到化学平衡状态的依据有____ (填序号)。
A.t时刻N2、H2、NH3的浓度不再改变
B.t时刻及其前后容器内气体的密度不再改变
C.t时刻及其前后容器内气体的平均相对分子质量相等
D.t时刻断裂的H−H键数目和生成的N−H键数目相等
③不同催化剂下合成氨反应的历程如下图所示,吸附在催化剂表面的物质用“*”表示。催化剂的催化效果更好的是____ (填“A”或“B”)。

(1)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。
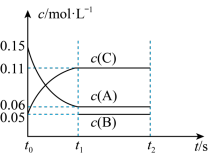
已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若
②写出该反应的化学方程式:
(2)已知部分化学键的键能如表:
| 化学键 | N≡N | H−H | N−H |
| 键能/( | 946 | 436 | a |
②已知工业合成氨反应
A.t时刻N2、H2、NH3的浓度不再改变
B.t时刻及其前后容器内气体的密度不再改变
C.t时刻及其前后容器内气体的平均相对分子质量相等
D.t时刻断裂的H−H键数目和生成的N−H键数目相等
③不同催化剂下合成氨反应的历程如下图所示,吸附在催化剂表面的物质用“*”表示。催化剂的催化效果更好的是

23-24高二上·福建漳州·阶段练习
类题推荐
完成下列问题。
(1)向某体积固定的密闭容器中加入 、
、 和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的物质的量没有变化。请回答:
和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的物质的量没有变化。请回答:
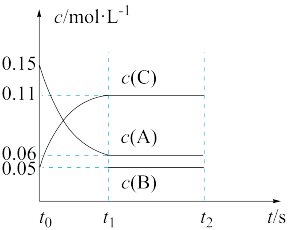
①若 ,则
,则 内反应速率
内反应速率
_______ ;
②写出反应的化学方程式:_______ 。
(2)已知部分化学键的键能如上表:
①请写出 合成
合成 的热化学方程式
的热化学方程式_______ 。
②在恒温恒容条件下,下列描述能说明合成氨反应达到化学平衡状态的有_______ (填序号)。
A.容器内的压强不变
B.容器内气体的密度不变
C.气体的平均相对分子质量不变
D.
E.相同时间内有 键断裂,有
键断裂,有 键形成
键形成
F.每有 氮气消耗的同时就有
氮气消耗的同时就有 氢气消耗
氢气消耗
(3)在 的密闭容器中,进行如下化学反应:
的密闭容器中,进行如下化学反应: 。化学平衡常数K与温度T的关系如表:
。化学平衡常数K与温度T的关系如表:
回答下列问题:
①该反应平衡常数的表达式为_______ ,该反应正反应_______ (填“放热”或“吸热”)。
②若某温度下,平衡浓度符合下列关系: ,此时的温度为
,此时的温度为____ 。在此温度下,向容器中充入 、
、 ,保持温度不变,重新达到平衡时,其平衡常数
,保持温度不变,重新达到平衡时,其平衡常数____ (填“增大”“减小”或“不变”)。
③若1200℃时,在某时刻反应混合物中各物质的浓度如下: 、
、 、
、 、
、 ,则此时上述反应平衡移动的方向为
,则此时上述反应平衡移动的方向为_____ (填“正反应方向”“逆反应方向”或“不移动”)。
(1)向某体积固定的密闭容器中加入

| 化学键 | |||
| 键能/( | 946 | 436 | 391 |
①若
②写出反应的化学方程式:
(2)已知部分化学键的键能如上表:
①请写出
②在恒温恒容条件下,下列描述能说明合成氨反应达到化学平衡状态的有
A.容器内的压强不变
B.容器内气体的密度不变
C.气体的平均相对分子质量不变
D.
E.相同时间内有
F.每有
(3)在
| 700 | 800 | 850 | 1000 | 1200 | |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应平衡常数的表达式为
②若某温度下,平衡浓度符合下列关系:
③若1200℃时,在某时刻反应混合物中各物质的浓度如下:
(1)在2L密闭容器中,起始投入4molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
①该反应的平衡常数K表达式为K=___ 。
②则K1___ K2(填“>”、“<”或“=”)。
③在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为___ ,平衡时H2的转化率为___ 若再同时增加各物质的量为1mol平衡常数___ (填“增大”、“减小”或“不变”)
④下列能说明该反应已达到平衡状态的是__ 。
A.3v(H2)正=2v(NH3)逆
B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态
D.ΔH保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
热化学方程式:___ 。
| 温度/K | 平衡时NH3的物质的量/mol |
| T1 | 3.6 |
| T2 | 2 |
①该反应的平衡常数K表达式为K=
②则K1
③在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为
④下列能说明该反应已达到平衡状态的是
A.3v(H2)正=2v(NH3)逆
B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态
D.ΔH保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
| 化学键 | H—H | N≡N | N—H |
| 键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网