解答题-原理综合题 适中0.65 引用1 组卷32
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长,因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题。
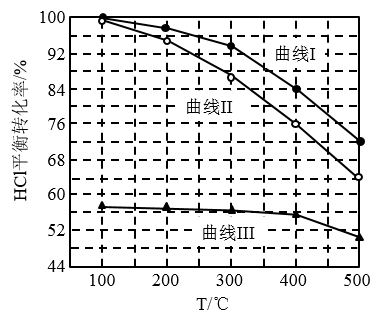
(1)氯化氢的直接氧化法为 。下图为刚性容器中,进料浓度比
。下图为刚性容器中,进料浓度比 分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
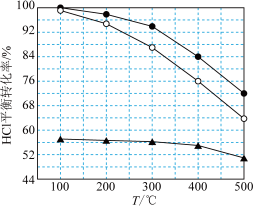
可知反应平衡常数K(200℃)______ K(300℃)(填“>”或“<”)。设HCl初始浓度为c,根据进料浓度比 的数据计算K(400℃)=
的数据计算K(400℃)=______ (列出计算式)。按化学计量数之比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 过低、过高的不利影响分别是
过低、过高的不利影响分别是_______ 、_______ 。
(2)直接氧化法可按下列催化过程进行:





则 的
的
_______  。
。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________ (写出2种)。
(1)氯化氢的直接氧化法为

可知反应平衡常数K(200℃)
(2)直接氧化法可按下列催化过程进行:
则
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是
23-24高二上·河南·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网