解答题-原理综合题 较难0.4 引用1 组卷177
CO广泛应用于冶金工业,是合成羰基类有机产品的重要原料。工业上常利用水蒸气和炽热焦炭制备CO:
i.

体系中还存在水煤气变换反应:
ii.

(1)已知 ,则
,则
___________ 。
(2)在一定温度下,向某恒容密闭容器中加入 和
和 ,发生反应
,发生反应 和
和 。已知起始时体系的压强为
。已知起始时体系的压强为 ,在不同条件下测定体系的总压强
,在不同条件下测定体系的总压强 如下表所示。
如下表所示。
①下列说法正确的是___________ 。
A.混合气体的平均摩尔质量保持不变,说明反应体系已达到平衡
B.平衡时CO2的体积分数可能为
C.采用对反应i选择性高的催化剂有利于提高CO的平衡产率
②条件I中,700—800℃范围内体系总压变化的原因可能为___________ 。
③条件II中,740℃时测得体系中的CO2分压p(CO2)=15kPa,该条件下H2O的消耗速率为___________ kPa·h-1,780℃时,测得体系中H2的平衡分压p(H2)=90kPa,则反应i在该温度下用平衡分压表示的平衡常数Kp=___________ 。
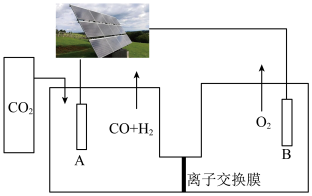
(3)电解还原CO2也是合成CO的重要途径,同时可实现CO2的资源化利用。以Au为电极材料、KHCO3溶液为电解质,往M极持续通入CO2,其他条件不变,恒定通过电解池的电量,测得M极含碳产物的法拉第效率(FE%) 随电解电压的变化如图所示。
随电解电压的变化如图所示。
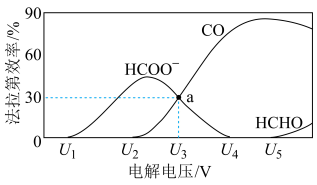
①电解时M极与电源的___________ 极相连。
②a点时,CO2发生电解反应的电极方程式为___________ 。
i.
体系中还存在水煤气变换反应:
ii.
(1)已知
(2)在一定温度下,向某恒容密闭容器中加入
| 条件 | T/℃ p/kPa | 700 | 720 | 740 | 760 | 780 | 800 |
| I | 催化剂1,2h | 140 | 110 | 108 | 112 | 117 | 125 |
| II | 催化剂2,2h | 125 | 132 | 140 | 150 | 163 | 170 |
| III | 催化剂2,h | 140 | 150 | 163 | 172 | 180 | 185 |
A.混合气体的平均摩尔质量保持不变,说明反应体系已达到平衡
B.平衡时CO2的体积分数可能为
C.采用对反应i选择性高的催化剂有利于提高CO的平衡产率
②条件I中,700—800℃范围内体系总压变化的原因可能为
③条件II中,740℃时测得体系中的CO2分压p(CO2)=15kPa,该条件下H2O的消耗速率为
(3)电解还原CO2也是合成CO的重要途径,同时可实现CO2的资源化利用。以Au为电极材料、KHCO3溶液为电解质,往M极持续通入CO2,其他条件不变,恒定通过电解池的电量,测得M极含碳产物的法拉第效率(FE%)

①电解时M极与电源的
②a点时,CO2发生电解反应的电极方程式为
23-24高三上·重庆·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网