解答题-原理综合题 适中0.65 引用1 组卷28
碳和氮的化合物是广泛的化工原料,回答下列问题:
I.在一定体积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度t的关系如下表:
,其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应为反应___________ (填“吸热”、“放热”)。
(2)某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为___________ ℃。
(3)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 ,
, ,
, ,
, ,则下一时刻,
,则下一时刻,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)反应达平衡后,向容器中通入与平衡混合气组成、比例相同的气体,达到新平衡时与原平衡相比,有关说法正确的是___________。
Ⅱ.NO2的二聚体 是火箭中常用氧化剂。完成下列问题。
是火箭中常用氧化剂。完成下列问题。
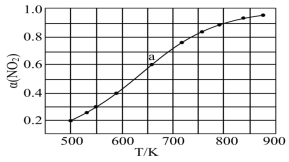
(5)在1000K下,在某恒容容器中发生下列反应: ,将一定量的
,将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率 随温度变化如图所示。图中a点对应温度下,已知
随温度变化如图所示。图中a点对应温度下,已知 的起始压强
的起始压强 为120KPa,列式计算该温度下反应的平衡常数
为120KPa,列式计算该温度下反应的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅲ.
(6)下图是利用甲烷燃料电池给C电极上镀金属铜,A电极的电极反应式为___________ ,若C电极增重0.96g,则B电极上消耗O2的物质的质量为___________ 。
I.在一定体积的密闭容器中,进行如下化学反应:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为反应
(2)某温度下,平衡浓度符合下式:
(3)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
(4)反应达平衡后,向容器中通入与平衡混合气组成、比例相同的气体,达到新平衡时与原平衡相比,有关说法正确的是___________。
| A.反应物转化率增大 | B.逆反应速率增大 |
| C.各物质的比例不变 | D. |
Ⅱ.NO2的二聚体
(5)在1000K下,在某恒容容器中发生下列反应:

Ⅲ.
(6)下图是利用甲烷燃料电池给C电极上镀金属铜,A电极的电极反应式为

23-24高二上·河北沧州·阶段练习
类题推荐
I.碳和氮的化合物是泛的化工原料,回答下列问题:
(1)在一定体积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度t的关系如下表:
,其化学平衡常数K和温度t的关系如下表:
回答下列问题:
①

②

③

依据盖斯定律,
_______ 
(2)某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为_______ ℃。(从上表温度中选择)
(3)830℃时,起始加入相同物质的量的 、
、 。在某平衡时刻
。在某平衡时刻 ,
, 的浓度为
的浓度为 ,则此时CO的浓度为
,则此时CO的浓度为_______  ,若此时降温至600℃,重新达到平衡后,CO的浓度为
,若此时降温至600℃,重新达到平衡后,CO的浓度为_______ 
II. 的二聚体
的二聚体 是火箭中常用氧化剂。在1000K下,在某恒容容器中发生下列反应:
是火箭中常用氧化剂。在1000K下,在某恒容容器中发生下列反应: ,将一定量的
,将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率 随温度变化如图所示。完成下列问题。
随温度变化如图所示。完成下列问题。
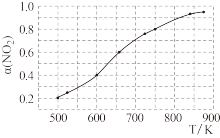
(4)该反应为_______ (“吸热”或“放热”)反应。
(5)能说明该反应达到平衡标志的有_______。
(6)图中a点对应温度下,已知 的起始压强
的起始压强 为120kP,列式计算该温度下反应的平衡常数
为120kP,列式计算该温度下反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)在一定体积的密闭容器中,进行如下化学反应:
| t℃ | 600 | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.36 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①
②
③
依据盖斯定律,
(2)某温度下,平衡浓度符合下式:
(3)830℃时,起始加入相同物质的量的
II.

(4)该反应为
(5)能说明该反应达到平衡标志的有_______。
| A.体系的压强不再变化 |
| B.NO的百分数不再改变 |
| C.单位时间内生成a mol的 |
| D.混合气体密度不再变化 |
碳和氮的化合物是广泛的化工原料,回答下列问题:
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应为______ 反应(填“吸热”、“放热”)。
(2)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为_____ ℃。
(3)1200℃时,在某刻体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡向____ 移动(填“正向”、“逆向”或“不”)。
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(4)在1000K下,在某恒容容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
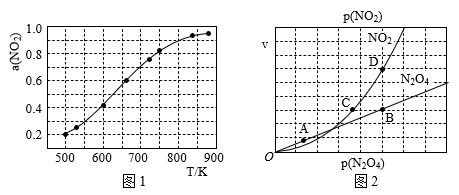
(5)对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=______ ;在图标出点中,指出能表示反应达到平衡状态的两个点_____ ,理由是_____ 。
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为
(2)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为
(3)1200℃时,在某刻体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡向
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(4)在1000K下,在某恒容容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=

(5)对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=
碳和氮的化合物是广泛的化工原料,回答下列问题:
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________ 。
(2)该反应为_______________ 反应(填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________ 。
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______ ℃。
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡向__________ 移动(填“正向”、“逆向”或“不”)。
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(1)在1000K下,在某恒容容器中发生下列反应:2NO2(g) 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下,NO2的转化率是0.6。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下,NO2的转化率是0.6。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
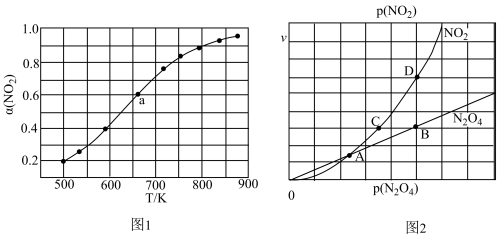
(2)对于反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________ ;在上图标出点中,指出能表示反应达到平衡状态的两个点__________ ,理由是__________________________ 。
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡向
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(1)在1000K下,在某恒容容器中发生下列反应:2NO2(g)

(2)对于反应N2O4(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


