解答题-原理综合题 适中0.65 引用2 组卷365
与氨气相关的化学变化是氮循环和转化的重要一环,对生产、生活有重要的价值。
(1)下图转化途径中属于“固氮”的是___________。

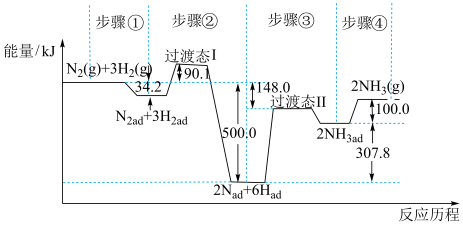
(2)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中 表示物质吸附在催化剂表面时的状态)
表示物质吸附在催化剂表面时的状态)

①由图可知合成氨反应 的
的
___________  ,对总反应速率影响较大的是步骤
,对总反应速率影响较大的是步骤___________ 。(填写编号)
②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是___________ 。
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(3)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用 的燃烧反应(
的燃烧反应( )能设计成燃料电池,其工作原理如图所示。电极
)能设计成燃料电池,其工作原理如图所示。电极 为
为___________ (选填“正”或“负”)极;电极 的电极反应式为
的电极反应式为___________ ;当正负极共消耗 (标准状况)气体时,通过负载的电子数为
(标准状况)气体时,通过负载的电子数为___________ 个。

合成氨厂的可用于合成重要化工原料 ,主要反应为:
,主要反应为: ,向两个容积固定为
,向两个容积固定为 的密闭容器中分别充入比例相同,但总量不同的
的密闭容器中分别充入比例相同,但总量不同的 和气体,
和气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
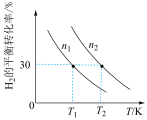
(4)①若 时,向容器中充入
时,向容器中充入 气体(
气体( 和
和 ),反应至
),反应至 时达到平衡,则
时达到平衡,则 内
内 的平均反应速率
的平均反应速率
___________ 。
②由上图可判断该反应是___________ (选填“吸热”或“放热”)反应,在___________ (填“较高”或“较低”)温度下有利于该反应自发进行。
③判断图中 、
、 相对大小,并说明理由。
相对大小,并说明理由。___________ 。
(1)下图转化途径中属于“固氮”的是___________。

| A.④⑤⑥ | B.①③④ | C.①⑤⑦ | D.②⑧⑨ |
(2)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中

①由图可知合成氨反应
②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(3)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用

合成氨厂的可用于合成重要化工原料

(4)①若
②由上图可判断该反应是
③判断图中
2023·上海浦东新·一模
类题推荐
合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如图:(图中ad表示物质吸附在催化剂表面时的状态) 2NH3(g)的△H=
2NH3(g)的△H=______ kJ•mol-1,对总反应速率影响较大的是步骤_______ 。(填写编号)
(2)若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是_______ 。
(3)下列关于硫酸工业和合成氨工业说法错误的是_______ 。
合成氨厂的CO2可用于合成重要化工原料CH3OH,主要反应为:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。_______ mol•L-1•min-1。
(5)由图可判断该反应是_______ (选填“吸热”或“放热”)反应,在______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(6)判断图中n1、n2相对大小:n1______ n2。(选填“<”或“>”)
(2)若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
| A.升高温度,使单位体积内活化分子百分数增加 |
| B.增加反应物的浓度,使活化分子百分数增加 |
| C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加 |
| D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加 |
(3)下列关于硫酸工业和合成氨工业说法错误的是
| A.都采用了高压 | B.都使用了催化剂 |
| C.生产流程中都有造气和净化 | D.都使用了热交换器 |
合成氨厂的CO2可用于合成重要化工原料CH3OH,主要反应为:3H2(g)+CO2(g)
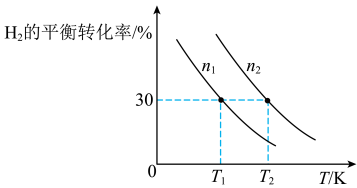
(5)由图可判断该反应是
(6)判断图中n1、n2相对大小:n1
合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中ad表示物质吸附在催化剂表面时的状态) 的
的
_______  ,对总反应速率影响较大步骤的化学方程式为
,对总反应速率影响较大步骤的化学方程式为_______ 。
【小题2】若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是_______。
起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如下图。
_______  (选填“>”“<”或“=”);理由是
(选填“>”“<”或“=”);理由是_______ 。
【小题4】该反应从开始到平衡时生成氨气的平均速率:
_______  ;反应的平衡常数:B点
;反应的平衡常数:B点_______ D点。(选填“>”“<”或“=”)
【小题5】C点 的转化率为
的转化率为_______ 。
【小题6】在恒温恒容密闭容器中,下列能判断合成氨的反应达到化学平衡时,下列说法正确的是_______。

【小题2】若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是_______。
| A.升高温度,使单位体积内活化分子百分数增加 |
| B.增加反应物的浓度,使单位体积内活化分子百分数增加 |
| C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加 |
| D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加 |
起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如下图。
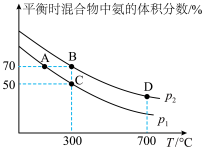
【小题4】该反应从开始到平衡时生成氨气的平均速率:
【小题5】C点
【小题6】在恒温恒容密闭容器中,下列能判断合成氨的反应达到化学平衡时,下列说法正确的是_______。
| A.正反应速率和逆反应速率相等且为零 | B.氮气和氢气的转化率相等 |
| C.氮气的转化率达到最大值 | D. |
甲醇是一种可再生能源,具有广泛的开发和应用前景,工业上一般采用下列两种反应合成甲醇:
反应①:
反应②:
(1)反应
_______ (用含 和
和 的式子表示)。
的式子表示)。
(2)在一定条件下将 和
和 充入
充入 的密闭容器中发生反应①,
的密闭容器中发生反应①, 后测得
后测得 ,计算可得此段时间的反应速率(用
,计算可得此段时间的反应速率(用 表示)为
表示)为_______  。
。
(3)下列关于反应 说法正确的是_______。
说法正确的是_______。
(4)一定条件下向 的密闭容器中充入
的密闭容器中充入 和
和 发生反应:
发生反应: ,
, 的平衡转化率与温度、压强的关系如图所示:
的平衡转化率与温度、压强的关系如图所示:

①A、B、C三点平衡常数 的中最小的为是
的中最小的为是_______ 。
②在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:
_______  (填“>”“<”或“=”)。B点的
(填“>”“<”或“=”)。B点的
_______ ( 为以分压表示的平衡常数;分压=总压×物质的量分数)。
为以分压表示的平衡常数;分压=总压×物质的量分数)。
(5)按如图所示装置利用 和
和 组成燃料电池,进行如下实验,并回答下列问题:
组成燃料电池,进行如下实验,并回答下列问题:
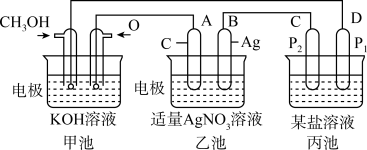
甲池,通入 (甲醇)的电极反应式为
(甲醇)的电极反应式为_______ ;当甲池中消耗 为
为 (标准状况下)时,理论上乙池中B极的质量增加
(标准状况下)时,理论上乙池中B极的质量增加_______ g。
反应①:
反应②:
(1)反应
(2)在一定条件下将
(3)下列关于反应
| A.增大反应物浓度,直接增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B.若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
| C.升高温度,化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.若加入催化剂,不影响反应活化能但能增大单位体积内活化分子百分数,从而增大化学反应速率 |

①A、B、C三点平衡常数
②在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:
(5)按如图所示装置利用

甲池,通入
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


