解答题-原理综合题 适中0.65 引用1 组卷120
当今世界多国相继规划了碳达峰、碳中和的时间节点,中国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低。2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。因此,降低空气中二氧化碳含量成为研究热点,其中研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和解决能源问题的方案之一、
Ⅰ.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
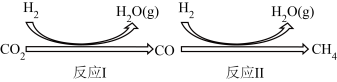
已知:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔHl=-205kJ∙mol-1
反应Ⅱ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH2=-246kJ∙mol-1
(1)则反应Ⅰ的热化学方程式为___________ 。
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应Ⅰ和反应Ⅱ;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率
___________ ,CH4的体积分数=___________ 。
Ⅱ.在催化剂作用下CO2加氢还可制得甲醇。
(3)能说明反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=+50kJ∙mol-1已达平衡状态的是___________(填字母)。
Ⅲ.催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH<0;
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0。
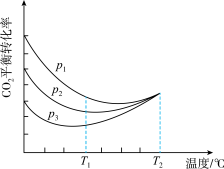
(4)向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为___________ ;T2℃时主要发生反应________ (填“①”或“②”)。
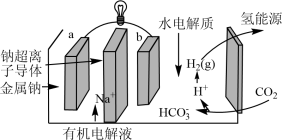
(5)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为________ 极,b极区的电极反应式为___________ 。
Ⅰ.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。

已知:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔHl=-205kJ∙mol-1
反应Ⅱ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH2=-246kJ∙mol-1
(1)则反应Ⅰ的热化学方程式为
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应Ⅰ和反应Ⅱ;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率
Ⅱ.在催化剂作用下CO2加氢还可制得甲醇。
(3)能说明反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=+50kJ∙mol-1已达平衡状态的是___________(填字母)。
| A.单位时间内生成1molCH3OH(g)的同时消耗了3molH2(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |
Ⅲ.催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH<0;
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0。
(4)向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为

(5)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为

23-24高三上·广西玉林·阶段练习
类题推荐
当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为___________ 。
Ⅰ.利用CO2制备CO
(2)CO2(g)+H2(g) CO(g)+H2O(g) ,一定条件下,向体积为2L的恒容密闭容器中通入2 mol CO2和6 mol H2发生上述反应,经5 min达到平衡时,容器中CO(g)为1.2 mol 。
CO(g)+H2O(g) ,一定条件下,向体积为2L的恒容密闭容器中通入2 mol CO2和6 mol H2发生上述反应,经5 min达到平衡时,容器中CO(g)为1.2 mol 。
①这段时间内以H2O(g)表示的化学反应速率为___________ 。
②求该反应的平衡常数
___________ 。
③下列事实能说明上述反应达到化学平衡状态的是___________ (填字母序号)。
A.体系内 B.体系压强不再发生变化
B.体系压强不再发生变化
C.体系内密度不再发生变化 D.体系内CO的物质的量分数不再发生变化
Ⅱ.利用 制备甲醇 (CH3OH)
制备甲醇 (CH3OH)
一定条件下,向恒容密闭容器中通入一定量的 和
和 ,涉及反应如下:
,涉及反应如下:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
副反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
已知:将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性= ×100%]随温度变化如图所示:
×100%]随温度变化如图所示:
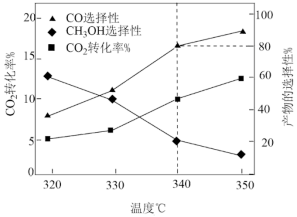
(3)340℃下,原料气通入10molCO2和一定量H2相同流速通过催化剂反应,出口处测得气体中n(CO)=___________ 。
(4)由图可知,随着温度的升高, 转化率升高,
转化率升高, 产率下降,解释其原因:
产率下降,解释其原因:___________ 。
Ⅲ.利用 生产其他含碳化合物
生产其他含碳化合物
(5)电催化还原CO2生成含碳产物(如CO、HCOOH等)原理如图所示:
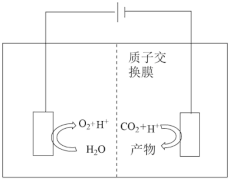
若阴极产物为HCOOH,则该电极反应式为___________ 。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热ΔH(kJ·mol-1) | -285 | -393 | -3 267 |
Ⅰ.利用CO2制备CO
(2)CO2(g)+H2(g)
①这段时间内以H2O(g)表示的化学反应速率为
②求该反应的平衡常数
③下列事实能说明上述反应达到化学平衡状态的是
A.体系内
C.体系内密度不再发生变化 D.体系内CO的物质的量分数不再发生变化
Ⅱ.利用
一定条件下,向恒容密闭容器中通入一定量的
主反应:CO2(g)+3H2(g)
副反应:CO2(g)+H2(g)
已知:将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性=

(3)340℃下,原料气通入10molCO2和一定量H2相同流速通过催化剂反应,出口处测得气体中n(CO)=
(4)由图可知,随着温度的升高,
Ⅲ.利用
(5)电催化还原CO2生成含碳产物(如CO、HCOOH等)原理如图所示:

若阴极产物为HCOOH,则该电极反应式为
当今,世界多国相继规划了碳达峰、碳中和的时间节点,降低空气中二氧化碳含量成为研究热点。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一。
(1)大气中二氧化碳的主要来源是煤、石油及其他含碳化合物的燃烧。已知25℃时:
①6C(石墨,s)+3H2(g)=C6H6(l) △H=+49.1kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
③H2(g)+ O2(g)=H2O(l) △H=-285.8kJ·mol-1
O2(g)=H2O(l) △H=-285.8kJ·mol-1
则25℃时C6H6(l)的燃烧热△H=___ 。
(2)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),改变氢碳比[
CH3OH(g)+H2O(g),改变氢碳比[ ],在不同温度下反应达到平衡状态,测得的实验数据如表。
],在不同温度下反应达到平衡状态,测得的实验数据如表。
①下列说法中正确的是___ (填标号)。
A.v(CH3OH)=v(CO2)时,反应达到平衡
B.增大氢碳比,平衡正向移动,平衡常数增大
C.CO2和H2合成甲醇为放热反应
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为___ 。
(3)二氧化碳催化加氢合成乙烯的原理为2CO2(g)+6H2(g) C2H4(g)+4H2O(g)。原料初始组成n(CO2):n(H2)=1:3,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。
C2H4(g)+4H2O(g)。原料初始组成n(CO2):n(H2)=1:3,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。

①CO2催化加氢合成C2H4反应的△H___ 0(填“大于”或“小于”)。
②根据图中点A(a、b两线交点),计算该温度时反应的平衡常数Kp=___ (MPa)-3(列出计算式,以分压表示,分压=总压×物质的量分数)。
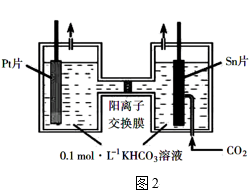
(4)电解法转化CO2可实现CO2的资源化利用,电解CO2制HCOO-的原理示意图如图2所示:装置中Pt片应与电源的___ 极相连,反应时阴极电极反应式为___ 。
(1)大气中二氧化碳的主要来源是煤、石油及其他含碳化合物的燃烧。已知25℃时:
①6C(石墨,s)+3H2(g)=C6H6(l) △H=+49.1kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
③H2(g)+
则25℃时C6H6(l)的燃烧热△H=
(2)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g)
| 温度/K CO2转化率/% | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 40 | 22 |
A.v(CH3OH)=v(CO2)时,反应达到平衡
B.增大氢碳比,平衡正向移动,平衡常数增大
C.CO2和H2合成甲醇为放热反应
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为
(3)二氧化碳催化加氢合成乙烯的原理为2CO2(g)+6H2(g)

①CO2催化加氢合成C2H4反应的△H
②根据图中点A(a、b两线交点),计算该温度时反应的平衡常数Kp=
(4)电解法转化CO2可实现CO2的资源化利用,电解CO2制HCOO-的原理示意图如图2所示:装置中Pt片应与电源的

我国明确提出2060年“碳中和”目标,意味着需要通过工艺改造、节能等措施减少在能源的产生、转换、消费过程中二氧化碳的排放。回答下列问题:
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行:
反应A:CH4(g) C(ads)+2H2(g);反应B:C(ads)+CO2(g)
C(ads)+2H2(g);反应B:C(ads)+CO2(g) 2CO(g)
2CO(g)
上述反应中C(ads)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图1所示。
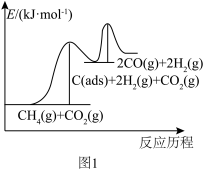
(1)总反应CH4(g)+CO2(g) 2H2(g)+2CO(g))能自发进行的条件为
2H2(g)+2CO(g))能自发进行的条件为_____ (填“高温”或“低温”);总反应速率由反应_____ 决定(填“A”或“B”)。
Ⅱ.将C催化还原,是目前处理CO2的重要方法。
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1<0
CH3OH(g)+H2O(g) ΔH1<0
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(2)已知CO和H2的燃烧热分别为-283kJ·mol-1和-285.8kJ·mol-1,H2O(1)=H2O(g) ΔH3=+44kJ·mol-1,则ΔH2=_____ kJ·mol-1
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2,发生反应i达到平衡,下列有关叙述正确的是_____(填标号)。
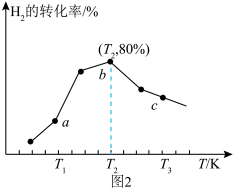
(4)在一定条件下,向1L恒容密闭容器中充入2molCO2和6molH2,发生反应i,测得在相同时间内,不同温度下H2的转化率如图2所示,T2时,若起始压强为10atm,则Kp=_____ atm-2(结果保留一位小数,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅲ.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图3所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气体匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图4所示。反应过程中始终未检测到CO2,检测到催化剂上有积碳。
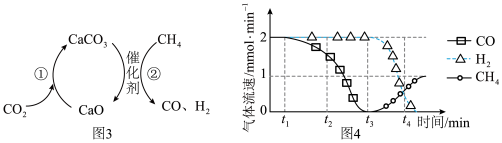
(5)t1~t3,n(H2)比n(CO)多,可能发生副反应的化学方程式为_____ 。
(6)t2后CO、CH4流速如图4变化的原因可能是_____ 。
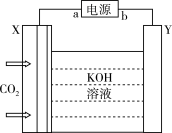
(7)用如图装置模拟科学研究在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应),X极上的电极反应式为_____ 。
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行:
反应A:CH4(g)
上述反应中C(ads)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图1所示。

(1)总反应CH4(g)+CO2(g)
Ⅱ.将C催化还原,是目前处理CO2的重要方法。
i.CO2(g)+3H2(g)
ii.CO2(g)+H2(g)
(2)已知CO和H2的燃烧热分别为-283kJ·mol-1和-285.8kJ·mol-1,H2O(1)=H2O(g) ΔH3=+44kJ·mol-1,则ΔH2=
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2,发生反应i达到平衡,下列有关叙述正确的是_____(填标号)。
| A.升高温度,逆反应速率增加,平衡常数减小 |
| B.按相同比例再加入一定量的CO2和H2,CO2和H2的转化率同时增大 |
| C.加入合适的催化剂可提高CO2的平衡转化率 |
| D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量 |
(4)在一定条件下,向1L恒容密闭容器中充入2molCO2和6molH2,发生反应i,测得在相同时间内,不同温度下H2的转化率如图2所示,T2时,若起始压强为10atm,则Kp=

Ⅲ.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图3所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气体匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图4所示。反应过程中始终未检测到CO2,检测到催化剂上有积碳。

(5)t1~t3,n(H2)比n(CO)多,可能发生副反应的化学方程式为
(6)t2后CO、CH4流速如图4变化的原因可能是
(7)用如图装置模拟科学研究在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应),X极上的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


