解答题-原理综合题 较难0.4 引用2 组卷189
CO、CO2、CH3OH等含碳物质是重要的基础化工原料。回答下列问题:
(1)CH3OH(l)气化时吸收的热量为27 kJ∙mol−1, CH3OH(g)的燃烧热为677 kJ∙mol−1,写出CH3OH(l)完全燃烧的热化学方程式:_________ 。
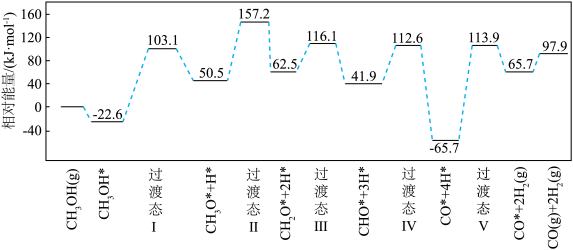
(2)CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。该历程中起决速步骤的化学方程式是_________ 。
(3)在恒温恒容密闭容器中投入足量石墨与CO2进行反应C(s)+CO2(g) 2CO(g),可判定其达到平衡的条件有_______(填序号)。
2CO(g),可判定其达到平衡的条件有_______(填序号)。
(4)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1
反应2:CO2(g) +H2(g) CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2
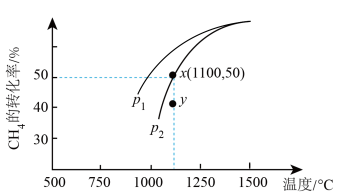
若起始按 =3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =
=3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH = ]
]

①p1_____ (填 “>”或“<”)p2。
②温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是_____ 。
③250 °C时反应2的压强平衡常数Kp=_______ (结果保留2位有效数字)。
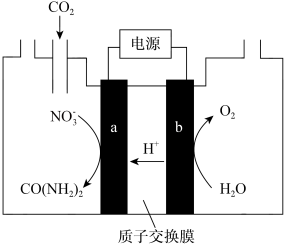
(5)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是_________ 。
(1)CH3OH(l)气化时吸收的热量为27 kJ∙mol−1, CH3OH(g)的燃烧热为677 kJ∙mol−1,写出CH3OH(l)完全燃烧的热化学方程式:
(2)CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。该历程中起决速步骤的化学方程式是

(3)在恒温恒容密闭容器中投入足量石墨与CO2进行反应C(s)+CO2(g)
| A.容器总压保持不变 | B.相同时间内,消耗1molCO2的同时生成2molCO |
| C.CO的体积分数保持不变 | D. |
(4)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g)
反应2:CO2(g) +H2(g)
若起始按

①p1
②温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是
③250 °C时反应2的压强平衡常数Kp=
(5)近年研究发现,电催化CO2和含氮物质(

23-24高二上·四川成都·期中
类题推荐
CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。
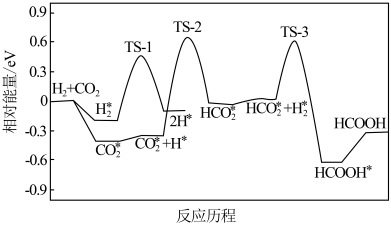
(1)在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。

该历程中起决速步骤的化学方程式是___________ 。
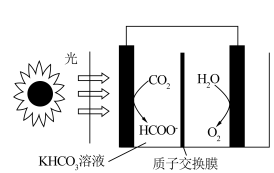
(2)我国科学家以Si/Bi材料作光电阴极。CO2饱和的0.5 mol ·L-1的KHCO3溶液作电解液(pH =7.4) ,将CO2转化为HCOO-,原理如图所示。根据图示,写出光电阴极的电极反应式:___________ 。
(3)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1
反应2:CO2(g) +H2(g) CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2
①已知:在一定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。下表为几种物质在298 K的标准摩尔生成焓:
则ΔH1 = ___________ 。
②若起始按 =3投料,测得CO2的平衡转化率(X - CO2)和CH3OH的选择性(S – CH3OH)随温度、压强的变化如图所示[已知:S –CH3OH =
=3投料,测得CO2的平衡转化率(X - CO2)和CH3OH的选择性(S – CH3OH)随温度、压强的变化如图所示[已知:S –CH3OH =
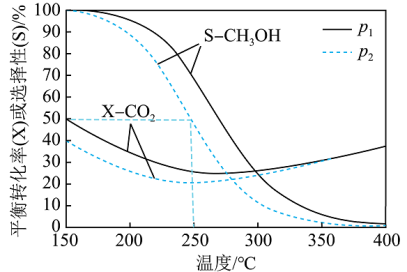
i.p1___________ (填 “>”或“<”)p2。
ii.温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是________ 。
iii.250 °C时反应2的压强平衡常数Kp=___________ ( 结果保留2位有效数字)。
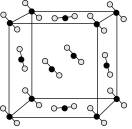
(4)一定条件下,CO2可形成干冰,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有___________ 个。若晶胞参数是a nm,干冰的密度为ρg· cm-3,则阿伏加德罗常数为___________ (用含a 、ρ的代数式表示)。
(1)在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。

该历程中起决速步骤的化学方程式是
(2)我国科学家以Si/Bi材料作光电阴极。CO2饱和的0.5 mol ·L-1的KHCO3溶液作电解液(pH =7.4) ,将CO2转化为HCOO-,原理如图所示。根据图示,写出光电阴极的电极反应式:

(3)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g)
反应2:CO2(g) +H2(g)
①已知:在一定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。下表为几种物质在298 K的标准摩尔生成焓:
| 物质 | CO2(g) | CH3OH(g) | H2O(g) | H2(g) |
| 标准摩尔生成焓/(kJ ·mol -1) | −393.51 | −201.17 | −241. 82 | 0 |
②若起始按

i.p1
ii.温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是
iii.250 °C时反应2的压强平衡常数Kp=
(4)一定条件下,CO2可形成干冰,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有

甲醇(CH3OH)是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8 kJ·mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
回答下列问题:
(1)下列说法正确的是___________ (填标号)。
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(2)据研究,反应过程中起催化作用的是Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是___________ (用化学方程式表示)。
(3)已知在25℃,101 kPa下:甲醇(l)的燃烧热△H=-725.8 kJ·mol-1,CO(g)的燃烧热△H=-283 kJ·mol-1,H2O(g)=H2O(l) △H=-44.0 kJ·mol-1。
则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为___________ 。
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
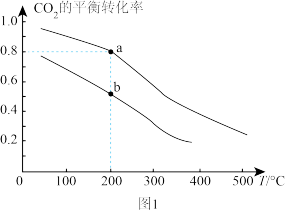
①a、b两点化学反应速率分别用va、vb,表示,则va___________ vb(填“大于”“小于”或“等于”)。
②a点对应的平衡常数K=___________ L2·mol-2(保留1位小数)。
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。
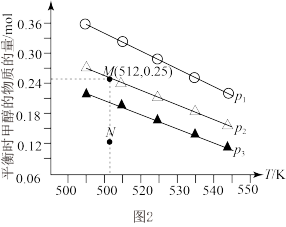
下列说法正确的是___________ (填标号)。
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
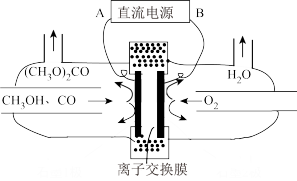
(6)以甲醇为主要原料,电化学合成碳酸二甲酯[(CH3O)2CO]的工作原理如图所示。直流电源的正极为___________ (填“A”或“B”),阳极的电极反应式为___________ 。
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CO、4 mol H2 |
| 平衡时的浓度 | c1 | c2 | c3 |
| 平衡时反应的能量变化为正值 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡时反应物的转化率 | α1 | α2 | α3 |
(1)下列说法正确的是
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(2)据研究,反应过程中起催化作用的是Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是
(3)已知在25℃,101 kPa下:甲醇(l)的燃烧热△H=-725.8 kJ·mol-1,CO(g)的燃烧热△H=-283 kJ·mol-1,H2O(g)=H2O(l) △H=-44.0 kJ·mol-1。
则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g)

①a、b两点化学反应速率分别用va、vb,表示,则va
②a点对应的平衡常数K=
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。

下列说法正确的是
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
(6)以甲醇为主要原料,电化学合成碳酸二甲酯[(CH3O)2CO]的工作原理如图所示。直流电源的正极为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网