填空题 较难0.4 引用1 组卷90
氧化还原反应在人类的生产、生活中有着重要的应用。回答下列问题:
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为 。该反应中,被还原的元素是
。该反应中,被还原的元素是________ (填元素符号),消耗的还原剂和氧化剂质量比为_________ 。
(2)实验室制备Cl2有三种常用方法:
a.
b.
c.
①配平反应b的方程式:___________ 。
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应_____ (填“a”“b”或“c”)。
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:___________ 。
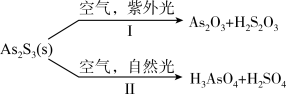
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
 ,
, 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I______ Ⅱ(填“>”“<”或“=”),转移的电子数之比为_______ 。
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为
(2)实验室制备Cl2有三种常用方法:
a.
b.
c.
①配平反应b的方程式:
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
23-24高一上·安徽阜阳·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网