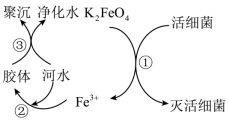
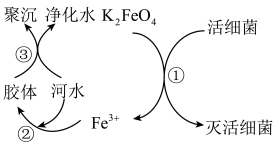
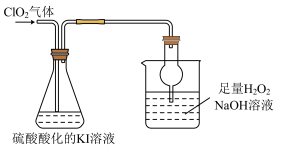解答题-工业流程题 适中0.65 引用1 组卷85
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。回答下列问题:
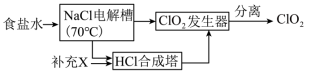
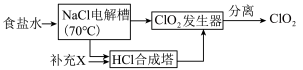
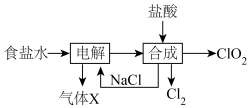
I.ClO2的制备,生产流程如下图所示:
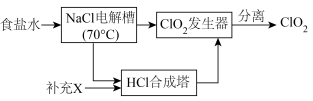
(1)用于电解的食盐水需先除去其中的 等杂质。向粗盐水中依次中加入过量的
等杂质。向粗盐水中依次中加入过量的___________ (填化学式)溶液、过量的 溶液和过量的
溶液和过量的___________ (填化学式)溶液,过滤后向滤液中加入盐酸至溶液呈中性。
(2)将经过净化后的食盐水加入电解槽中,70℃左右电解得到 和一种气体,则
和一种气体,则 合成塔中还需要补充的物质X为
合成塔中还需要补充的物质X为___________ (填化学式)。
(3)ClO2发生器中发生的反应为: (反应未配平)。
(反应未配平)。
① 在该反应中表现的性质是
在该反应中表现的性质是___________ 。
②配平该反应的化学方程式,并用单线桥法标出电子转移的数目 ___________ 。
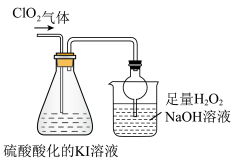
II.探究ClO2的某些性质,装置如下图所示:
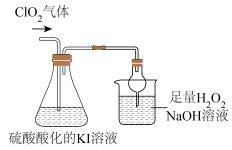
已知:①ClO2是极易溶于水的气体:②I2遇淀粉溶液变为蓝色
(4)反应结束后,往锥形瓶内滴加淀粉溶液,溶液变为蓝色,写出ClO2通入锥形瓶中反应的离子方程式___________ 。
(5)上图装置中,球形干燥管的作用是___________ 。烧杯内液体用于吸收未反应的CO2,若反应的氧化产物是 ,且氧化剂与还原剂的个数之比是
,且氧化剂与还原剂的个数之比是 ,则还原产物是
,则还原产物是___________ (填化学式)。
I.ClO2的制备,生产流程如下图所示:

(1)用于电解的食盐水需先除去其中的
(2)将经过净化后的食盐水加入电解槽中,70℃左右电解得到
(3)ClO2发生器中发生的反应为:
①
②配平该反应的化学方程式,
II.探究ClO2的某些性质,装置如下图所示:

已知:①ClO2是极易溶于水的气体:②I2遇淀粉溶液变为蓝色
(4)反应结束后,往锥形瓶内滴加淀粉溶液,溶液变为蓝色,写出ClO2通入锥形瓶中反应的离子方程式
(5)上图装置中,球形干燥管的作用是
23-24高一上·重庆·期中
类题推荐
二氧化氯( )是第四代杀菌消毒剂,因其高效、无污染而被广泛使用。图是氯化钠电解法生产
)是第四代杀菌消毒剂,因其高效、无污染而被广泛使用。图是氯化钠电解法生产 的工艺流程。已知:①二氧化氯是一种强氧化性气体,呈黄绿色,易溶于水的,不与水反应。②
的工艺流程。已知:①二氧化氯是一种强氧化性气体,呈黄绿色,易溶于水的,不与水反应。② 和
和 的熔沸点如表所示。
的熔沸点如表所示。
(1)用于电解的食盐水需先除去其中的 、
、 、
、 等杂质。向粗盐水中依次中加入
等杂质。向粗盐水中依次中加入________ 溶液、过量的NaOH溶液和过量的 溶液,过滤后向滤液中加入盐酸至溶液呈中性。
溶液,过滤后向滤液中加入盐酸至溶液呈中性。
(2)将食盐水加入电解槽中,70℃左右电解得到氯酸钠( )和气体X,则X的化学式为
)和气体X,则X的化学式为___________ 。
(3)“合成”中的化学反应方程式为___________ 。
(4)分离 和
和 混合气体可采用的方法是
混合气体可采用的方法是___________ 。

| 物质 | 熔点/℃ | 沸点/℃ |
| -59 | 11 | |
| -107 | -34.6 |
(1)用于电解的食盐水需先除去其中的
(2)将食盐水加入电解槽中,70℃左右电解得到氯酸钠(
(3)“合成”中的化学反应方程式为
(4)分离
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网