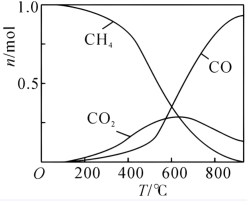
解答题-原理综合题 较难0.4 引用1 组卷79
Ⅰ.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500 ℃时催化剂效果最好
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
(2)分析表格数据,为了使SO2尽可能多地转化为SO3,应选择______ ℃、______ Mpa下进行实验。
(3)在实际生产中,选定的温度为400~500 ℃,原因是___
(4)在实际生产中,采用的压强为常压,原因是______
(5)在实际生产中,通入过量的空气,原因是_____
(6)尾气中SO2必须回收,原因是______
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:

已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为_____ ,CH3CH2OH(g)的体积分数为_____ %(保留一位小数)。
(8)此温度下,该反应的化学平衡常数Kp=_____ MPa-1(用平衡分压代替平衡浓度计算,列出计算式,不要求计算结果)。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
| A.SO2的体积分数不再变化 | B.混合物的密度不再变化 |
| C.v(SO2)=2v(O2) | D.气体的压强不再变化 |
(3)在实际生产中,选定的温度为400~500 ℃,原因是
(4)在实际生产中,采用的压强为常压,原因是
(5)在实际生产中,通入过量的空气,原因是
(6)尾气中SO2必须回收,原因是
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)

已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为
(8)此温度下,该反应的化学平衡常数Kp=
23-24高二上·广东深圳·期中
类题推荐
在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol−1,(已知:催化剂是V2O5,在400~500 ℃时催化剂效果最好)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=−196.6 kJ·mol−1,(已知:催化剂是V2O5,在400~500 ℃时催化剂效果最好)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是___________ 。
(2)在实际生产中,选定的温度为400~500 ℃,原因是___________ 。
(3)在实际生产中,采用的压强为常压,原因是___________ 。
(4)在实际生产中,通入过量的空气,原因是___________ 。
(5)尾气中SO2必须回收,原因是___________ 。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(2)在实际生产中,选定的温度为400~500 ℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中SO2必须回收,原因是
二氧化碳催化加氢制甲醇有利于减少温室气体排放。涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

(1)
_______  ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是_______ (填标号)。
A.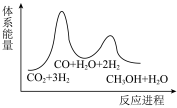 B.
B.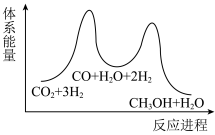
C.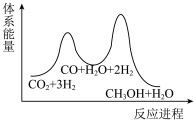 D.
D.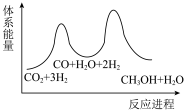
(2)一定条件下,恒容密闭容器中 和
和 发生上述反应。下列说法正确的是_______。
发生上述反应。下列说法正确的是_______。
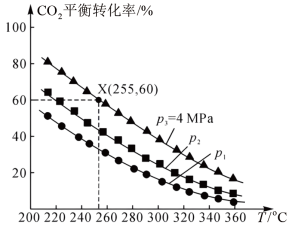
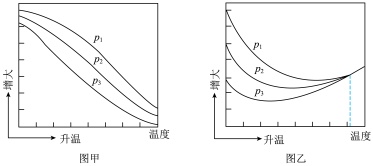
(3)不同压强下,按照 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知: 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图_______ (填“甲”或“乙”),压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ,图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是_______ 。
(4)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。热化学方程式为:C2H4(g)+H2O(g) CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
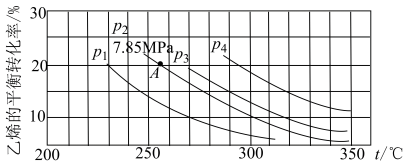
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.
Ⅱ.
Ⅲ.
(1)
A.
 B.
B.
C.
 D.
D.
(2)一定条件下,恒容密闭容器中
| A.当混合气体密度不变时说明体系达到平衡状态 |
| B.反应达到平衡状态后通入氦气,体系压强增大,反应速率不变,平衡不移动 |
| C.使用高效催化剂,可提高甲醇的生产效率,但不能改变甲醇的平衡产率 |
| D.实际生产中温度越低越有利于甲醇的合成 |
(3)不同压强下,按照

已知:
其中纵坐标表示
(4)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。热化学方程式为:C2H4(g)+H2O(g)

计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网