解答题-原理综合题 较难0.4 引用1 组卷53
天然气开采过程中产生大量的含硫废水(硫元素的主要存在形式为  需要回收处理并加以利用,有关反应如下:
需要回收处理并加以利用,有关反应如下:
ⅰ.
ⅱ. △H₂
△H₂
ⅲ.

回答下列问题:
(1)H₂S热分解反应 的
的
___________ (用含  的式子表示);若起始加1molH₂气体在刚性容器中发生该分解反应,下列说法
的式子表示);若起始加1molH₂气体在刚性容器中发生该分解反应,下列说法不能 说明该反应已达平衡的是___________ (填序号)
A.H₂S 与S₂ 的物质的量之比保持2:1不变
B.容器中混合气体平均摩尔质量保持不变
C. 保持不变
保持不变
D.容器中混合气体的颜色保持不变
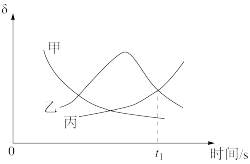
(2)总压恒定为 100kPa,向密闭容器中充入 发生反应i和反应ii,反应过程中
发生反应i和反应ii,反应过程中  )等含硫物质的分布分数δ随时间变化如图所示。
)等含硫物质的分布分数δ随时间变化如图所示。
①表示 分布分数的曲线为
分布分数的曲线为___________ (填“甲”“乙”或“丙”)。
②t₁时测得 转化率为α,此时体系中
转化率为α,此时体系中  的物质的量为
的物质的量为___________ mol;用  分压表示的平均反应速率为
分压表示的平均反应速率为___________ (用含α、t₁的式子表示,列出计算式即可) 
(3)也可采用 氧化法对
氧化法对  进行处理,过程中发生反应的方程式(均未配平)为:
进行处理,过程中发生反应的方程式(均未配平)为:
ⅰ.
ⅱ.
ⅲ.
实验测得,在 时,
时,  的投加量对平衡体系中部分微粒浓度的影响如图所示。
的投加量对平衡体系中部分微粒浓度的影响如图所示。
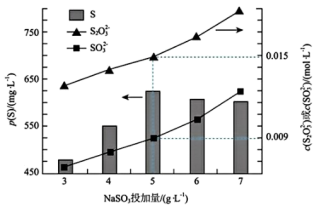
①T℃时,反应iii的平衡常数 K=___________ 。
②结合三个反应分析,当 投加量高于
投加量高于  时,单位体积内 S 的质量减小的原因为:
时,单位体积内 S 的质量减小的原因为:___________ 。
ⅰ.
ⅱ.
ⅲ.
回答下列问题:
(1)H₂S热分解反应
A.H₂S 与S₂ 的物质的量之比保持2:1不变
B.容器中混合气体平均摩尔质量保持不变
C.
D.容器中混合气体的颜色保持不变
(2)总压恒定为 100kPa,向密闭容器中充入

①表示
②t₁时测得
(3)也可采用
ⅰ.
ⅱ.
ⅲ.
实验测得,在

①T℃时,反应iii的平衡常数 K=
②结合三个反应分析,当
23-24高三上·陕西汉中·阶段练习
类题推荐
Ⅰ.天然气开采过程会产生大量含硫废水(硫元素的主要存在形式为 ),可采用
),可采用 氧化法对其进行处理。
氧化法对其进行处理。
(1)下列事实中,能够比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
Ⅱ.已知:氧化还原反应可拆分为氧化、还原两个半反应,电极电势分别表示为 和
和 ,电势差
,电势差 。如
。如 的
的 。两组电对的电势差越大,反应的自发程度越大。
。两组电对的电势差越大,反应的自发程度越大。
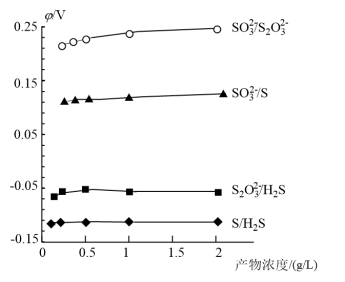
(2)各电对的电极电势与产物浓度的关系如图1所示,将体系中自发程度最大的反应记为ⅰ,反应ⅰ的离子方程式为___________ 。各微粒的相对能量如下表:
已知反应ⅰ为放热反应,当有 发生反应ⅰ时,释放的能量为
发生反应ⅰ时,释放的能量为___________  。(用含字母的代数式表示)
。(用含字母的代数式表示)
(3) 时,向浓度为
时,向浓度为 的
的 溶液中加入一定量
溶液中加入一定量 固体,在不同
固体,在不同 下的
下的 去除率随时间变化如图所示。
去除率随时间变化如图所示。
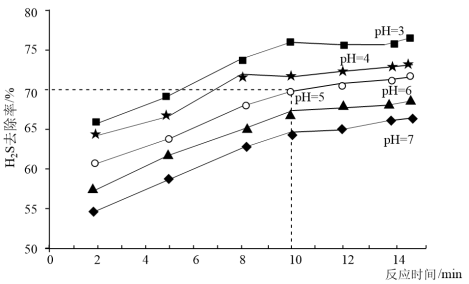
①实际生产中采取 的去除条件,而不选择更低
的去除条件,而不选择更低 的原因为
的原因为___________ 。
② 时,前
时,前 的去除速率
的去除速率
___________  ;实际生产中反应时间选择
;实际生产中反应时间选择 而不是更长,其原因为
而不是更长,其原因为___________ 。
(4)已知反应过程中还会发生如下两个反应(均未配平):
ⅱ.
ⅲ
实验测得,在 、
、 时,
时, 的投加量对平衡体系中部分微粒浓度的影响如图所示。
的投加量对平衡体系中部分微粒浓度的影响如图所示。
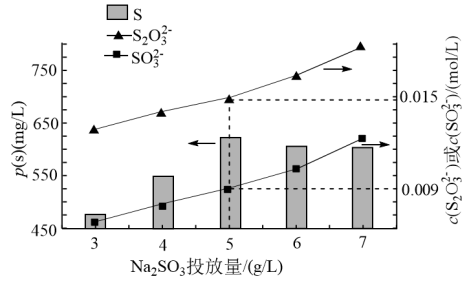
① 时,反应ⅲ的平衡常数
时,反应ⅲ的平衡常数
___________ 。
②结合反应ⅰ、ⅱ、ⅲ分析,当 投加量高于
投加量高于 时,单位体积内S的质量减小的原因为
时,单位体积内S的质量减小的原因为___________ 。
(1)下列事实中,能够比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
| A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B.氢硫酸的导电能力低于亚硫酸 |
| C.常温下, |
| D.氢硫酸的还原性强于亚硫酸 |
Ⅱ.已知:氧化还原反应可拆分为氧化、还原两个半反应,电极电势分别表示为
(2)各电对的电极电势与产物浓度的关系如图1所示,将体系中自发程度最大的反应记为ⅰ,反应ⅰ的离子方程式为
| 相对能量 | a | b | 0 | c | d | e |

(3)

①实际生产中采取
②
(4)已知反应过程中还会发生如下两个反应(均未配平):
ⅱ.
ⅲ
实验测得,在

①
②结合反应ⅰ、ⅱ、ⅲ分析,当
在工业上,常用CO和H2合成甲醇,其相关的反应原理方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知:①CO(g)+ O2(g)= CO2(g) △H1= a kJ/mol
O2(g)= CO2(g) △H1= a kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2= b kJ/mol
O2(g)=H2O(g) △H2= b kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
回答下列问题:
(1)△H=___________ kJ/mol 。
(2)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。

①当起始 =2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)
=2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)___________ 。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将___________ (选填“增大”、“减小”或“不变”);
②当起始 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“D”、“E”或“F”) 。
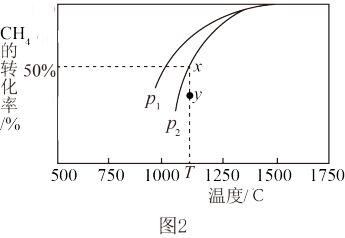
(4)已知CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1___________ P2(选填“>” “<” 或“=”);当压强为P2时,在y点:v(正)___________ v(逆)(选填“大于”、“小于”或“等于”)。若P2=3MPa且在恒压体系中发生,则T℃时该反应的平衡常数Kp = ___________ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
已知:①CO(g)+
②H2(g)+
③CH3OH(g)+
回答下列问题:
(1)△H=
(2)能说明反应CO(g)+2H2(g)
| A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |

①当起始
②当起始
(4)已知CO2(g)+CH4(g)

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网