填空题 适中0.65 引用1 组卷126
研究电解质在水溶液中的离子反应与平衡有重要的意义。
Ⅰ.室温下,有浓度均为0.1 mol·L 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
①HCl②NaCl③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸 ;碳酸
;碳酸 ,
, 。
。
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),水的电离被促进的是_______ ,溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(2)上述溶液的pH由大到小的顺序为_______ 。
(3)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“=”或“>”)。
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为_______ 。
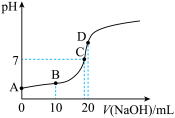
(5)向20 mL 0.1 mol/L 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。

①滴加过程中发生反应的离子方程式是_______ 。
②下列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足:
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。
(6) 的电离平衡常数表达式
的电离平衡常数表达式
_______ 。
(7)25℃时,等物质的量浓度的NaClO溶液和 溶液中,碱性较强的是
溶液中,碱性较强的是_______ 。
(8)25℃时,若初始时醋酸中 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
_______ mol⋅L 。(已知:
。(已知: )
)
(9)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸:
c.NaClO溶液中通入 :
:
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水:
Ⅰ.室温下,有浓度均为0.1 mol·L
①HCl②NaCl③
资料:室温下电离常数,醋酸
(1)上述溶液中水的电离被抑制的是
(2)上述溶液的pH由大到小的顺序为
(3)比较溶液③和④中
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为
(5)向20 mL 0.1 mol/L

①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足:
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时
| 化学式 | HClO | ||
| 电离平衡常数( |
(6)
(7)25℃时,等物质的量浓度的NaClO溶液和
(8)25℃时,若初始时醋酸中
(9)依据上表数据,下列方程式书写合理的是
a.
b.
c.NaClO溶液中通入
d.
23-24高二上·北京西城·期中
类题推荐
电离常数是研究电解质在水溶液中行为的重要工具。室温下一些酸的电离常数如下表所示
现有室温下,浓度均为0.2mol/L的下列五种溶液,请回答问题。
①HCl ②NaCl ③ ④
④ ⑤
⑤
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),请结合化学用语解释0.2mol/L的 的
的 的原因:
的原因:_______ 。
(2)浓度相同的阴离子在水溶液中结合 的能力:
的能力:
_______  (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
(3)上述溶液的pH由大到小的顺序为_______ 。
(4)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“>”或“=”)。
(5)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸:
c. 溶液中通入
溶液中通入 ;
;
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水:
(6)常温下,在电离平衡体系中,含Se(+4价)微粒的物质的量分数与pH的关系如图所示。
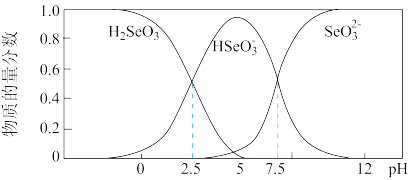
下列说法不正确 的是_______ (填序号)。
a. 溶液显酸性
溶液显酸性
b. 时,溶液中存在
时,溶液中存在
c. 溶液中,
溶液中,
d. 溶液中,
溶液中,
| 化学式 | HClO | ||
| 电离常数( |
①HCl ②NaCl ③
(1)上述溶液中水的电离被抑制的是
(2)浓度相同的阴离子在水溶液中结合
(3)上述溶液的pH由大到小的顺序为
(4)比较溶液③和④中
(5)依据上表数据,下列方程式书写合理的是
a.
b.
c.
d.
(6)常温下,在电离平衡体系中,含Se(+4价)微粒的物质的量分数与pH的关系如图所示。

下列说法
a.
b.
c.
d.
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网