解答题-原理综合题 较难0.4 引用1 组卷131
氯碱工业的产物可用于制取“84”消毒液的主要成份次氯酸钠。
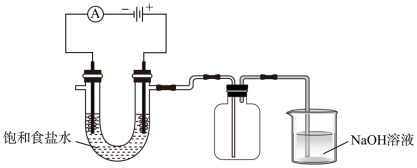
I.常温下,将 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
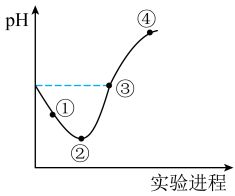
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
(2)③点所示溶液中:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);
(3)比较水的电离程度:曲线③点处___________ 曲线②点处。
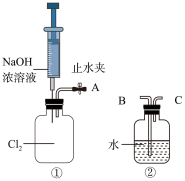
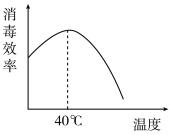
II.探究发现 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
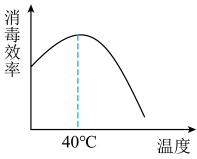
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因_______ 。
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中 的含量。
的含量。
其实验步骤为:称取工业烧碱 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)
(5)上述实验步骤中需要用到的全部定量仪器有:___________ 。
(6)计算该样品中 的质量分数为
的质量分数为___________ 。(用小数表示,保留至小数点后第3位)
(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
I.常温下,将

(1)在新制氯水中,下列关系正确的是___________(选填编号)。
| A. | B. |
| C. | D. |
(2)③点所示溶液中:
(3)比较水的电离程度:曲线③点处
II.探究发现

(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中
其实验步骤为:称取工业烧碱
(5)上述实验步骤中需要用到的全部定量仪器有:
(6)计算该样品中
(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
| A.工业烧碱已发生潮解 | B.滴定时往锥形瓶中加水 |
| C.配制的待测液敞口放置时间过长 | D.滴定管水洗后未用标准盐酸润洗 |
22-23高二上·上海·期末
类题推荐
某氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中NaOH的含量。其实验步骤为:称取工业烧碱1.100g,配成250mL溶液,取出25.00mL,先加入 溶液(过量),过滤后向滤液中滴入酚酞指示剂,再用
溶液(过量),过滤后向滤液中滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸18.56mL。
的盐酸滴定至终点,平均消耗盐酸18.56mL。
【小题1】计算该样品中NaOH的质量分数为_____ 。(用小数表示,保留至小数点后第3位)
【小题2】某次检测发现,实验值明显高于理论值,原因可能是_____。
【小题1】计算该样品中NaOH的质量分数为
【小题2】某次检测发现,实验值明显高于理论值,原因可能是_____。
| A.滴定管水洗后未用标准盐酸润洗 | B.工业烧碱已发生潮解 |
| C.配制的待测液敞口放置时间过长 | D.滴定时往锥形瓶中加水 |
氧化还原反应在生产、生活乃至生命活动中有着十分重要的作用。此外,化学电源是把化学能转变为电能的装置,现代生活离不开化学电源,而这也与氧化还原反应有关。
(1)下列实验基本操作正确的是_____ (单选)。
I.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中NaOH的含量。
其实验步骤为:称取工业烧碱2.088g,配成500mL溶液,取出25.00mL,先加入25.00mL0.05mol•L-1BaCl2溶液(过量),然后滴入酚酞指示剂,再用0.1200mol•L-1的盐酸滴定至终点,平均消耗盐酸18.56mL。
(2)计算该样品中NaOH的质量分数为______ 。(用小数表示,保留至小数点后第3位)
(3)滴定终点的现象是______ 。
(4)某次检测发现,实验值明显高于理论值,原因可能是_____ (单选)。
Ⅱ.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入品红试液中,溶液褪色的理由是______ 。
(6)请配平下列反应的化学方程式并用单线桥法标出电子转移的方向和数目(CH3OH中H为+1价,O为-2价):_____ 。
_____CH3OH+_____NaClO3+_____=_____CO2↑+_____ClO2↑+_____Na2SO4+_____
(7)该反应中,被氧化的元素是______ 。
(8)根据上述反应可推知_____ (不定项)。
(1)下列实验基本操作正确的是
| A.用碱式滴定管量取0.10mol•L-1的NaOH溶液11.10mL |
| B.中和热测定实验中若热量计保温效果不好则测得中和热结果绝对值偏大 |
| C.经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等 |
| D.用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6 |
I.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中NaOH的含量。
其实验步骤为:称取工业烧碱2.088g,配成500mL溶液,取出25.00mL,先加入25.00mL0.05mol•L-1BaCl2溶液(过量),然后滴入酚酞指示剂,再用0.1200mol•L-1的盐酸滴定至终点,平均消耗盐酸18.56mL。
(2)计算该样品中NaOH的质量分数为
(3)滴定终点的现象是
(4)某次检测发现,实验值明显高于理论值,原因可能是
| A.工业烧碱已发生潮解 | B.滴定管水洗后未用标准盐酸润洗 |
| C.配制的待测液敞口放置时间过长 | D.滴定时往锥形瓶中加水 |
Ⅱ.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入品红试液中,溶液褪色的理由是
(6)请配平下列反应的化学方程式并用单线桥法标出电子转移的方向和数目(CH3OH中H为+1价,O为-2价):
_____CH3OH+_____NaClO3+_____=_____CO2↑+_____ClO2↑+_____Na2SO4+_____
(7)该反应中,被氧化的元素是
(8)根据上述反应可推知
| A.氧化性:ClO2>NaClO3 |
| B.还原性:CH3OH>ClO2 |
| C.还原产物与氧化产物的物质的量之比为6:1 |
| D.当有4.48LClO2生成时,转移电子物质的量为0.2mol |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网