填空题 适中0.65 引用1 组卷29
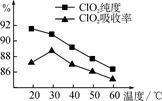
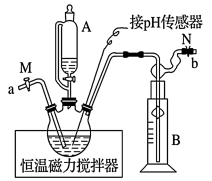
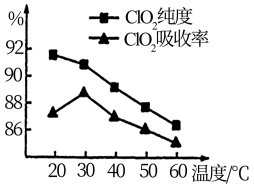
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。
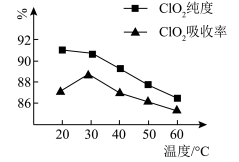
(1)据图可知,反应时需要控制的适宜温度是_____ ℃,要达到此要求需要采取的措施是_____ 。
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO 氧化成
氧化成 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:_____ 。
(3)CuSO4在酸性条件下能与FeS2反应生成难溶于水的Cu2S、 ,已知铁元素的化合价没有发生变化,写出该反应的离子方程式:
,已知铁元素的化合价没有发生变化,写出该反应的离子方程式:_____ 。
(4)实验室制备氯气的化学反应方程式为:_____ 。实验证明,很多物质都能与Cl-反应得到氯气,请写出重铬酸钾与盐酸反应生成Cr3+和氯气的离子方程式:_____ 。

(1)据图可知,反应时需要控制的适宜温度是
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO
(3)CuSO4在酸性条件下能与FeS2反应生成难溶于水的Cu2S、
(4)实验室制备氯气的化学反应方程式为:
23-24高一上·安徽安庆·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网