解答题-实验探究题 较难0.4 引用2 组卷239
乙酰苯胺俗称退热冰,是常用的化工原料和重要的化学试剂。某实验小组拟用一定量的乙酸和苯胺制备一定量的乙酰苯胺,具体实验步骤如下:
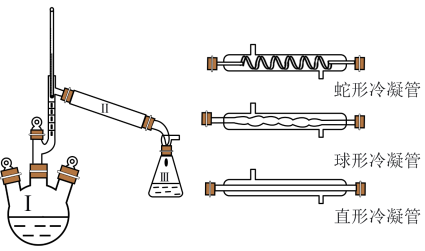
步骤1:安装装置,检查好气密性后向100mL三颈烧瓶中加入5.0mL苯胺、7.4mL乙酸(足量)和0.1g锌粉,加入沸石后,加热微沸回流,控制温度计温度为105C左右,反应40~60min。
步骤2:冷却后取下三颈烧瓶,搅拌下趁热倒入100mL冷水中,剧烈搅拌,冷却至室温,抽滤,压干。用5~10mL冷水洗涤,抽滤,压干,得到粗品。
步骤3:粗产品用150mL热水溶解,稍冷后,加入约0.2g活性炭,搅拌下加热煮沸1~2min,趁热抽滤,将滤液自然冷却至室温,晶体析出,抽滤,压干,干燥,称重。
已知:
回答下列问题
(1)Ⅱ处空白位置应选择的仪器为___________ (填“蛇形冷凝管”“球形冷凝管”或“直形冷凝管”);反应开始后发现忘加沸石,正确的操作为___________ 。
(2)步骤1中,发生反应的化学方程式是___________ ;温度计控温在105℃的原因是___________ 。
(3)步骤2中,用冷水进行洗涤的原因是___________ 。
(4)步骤3中,趁热抽滤的目的是___________ 。
(5)步骤3中,得到纯净乙酰苯胺6.3g,则实验产率为___________ (结果保留2位有效数字)。

步骤1:安装装置,检查好气密性后向100mL三颈烧瓶中加入5.0mL苯胺、7.4mL乙酸(足量)和0.1g锌粉,加入沸石后,加热微沸回流,控制温度计温度为105C左右,反应40~60min。
步骤2:冷却后取下三颈烧瓶,搅拌下趁热倒入100mL冷水中,剧烈搅拌,冷却至室温,抽滤,压干。用5~10mL冷水洗涤,抽滤,压干,得到粗品。
步骤3:粗产品用150mL热水溶解,稍冷后,加入约0.2g活性炭,搅拌下加热煮沸1~2min,趁热抽滤,将滤液自然冷却至室温,晶体析出,抽滤,压干,干燥,称重。
已知:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g/mL) | 溶解性 | |
| 乙酸 | 60 | 16.6 | 117.9 | 1.05 | 能溶于水、乙醇、乙醚 |
| 苯胺 | 93 | -6 | 184 | 1.022 | 微溶于水,易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 114 | 304 | 1.12 | 微溶于冷水,能溶于热水 |
(1)Ⅱ处空白位置应选择的仪器为
(2)步骤1中,发生反应的化学方程式是
(3)步骤2中,用冷水进行洗涤的原因是
(4)步骤3中,趁热抽滤的目的是
(5)步骤3中,得到纯净乙酰苯胺6.3g,则实验产率为
23-24高三上·河北石家庄·阶段练习
类题推荐
乙酰苯胺是一种无色有闪光的小叶状固体或白色晶性粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂。乙酰苯胺的一种制备原理为:
实验步骤:
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。
【步骤3】稍冷后,加入 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。
【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
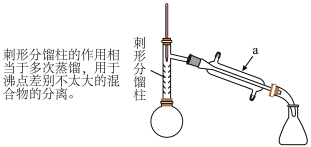
(1)仪器a的名称_____ 。
(2)【步骤1】加热可用_____ (填“水浴”或“油浴”)。
(3)制备过程中加入锌粉的作用为_____ 。
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在 左右的原因:
左右的原因:_____ 。
(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是_____ 。
(6)该实验最终得到纯品 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为_____ (保留一位小数)。
(7)乙酰苯胺可以在 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:_____ 。
(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到_____ 现象时,反应基本结束。
| 名称 | 相对分子质量 | 性状 | 密度 | 沸点/℃ | 溶解度 | 备注 |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚 | 易被氧化 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水,易溶于乙醇、乙醚 | |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺
【步骤3】稍冷后,加入
【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称
(2)【步骤1】加热可用
(3)制备过程中加入锌粉的作用为
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在
(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是
(6)该实验最终得到纯品
(7)乙酰苯胺可以在
(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到

乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是礦胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙耽苯胺的制备原理为:
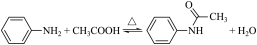
实验参数:
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
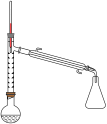
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30mL,冰醋酸15.4mL,锌粉0.100g,安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制。在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是________ 。
a. 25ml b. 50ml c. 150ml d. 200ml
(2)实验中加入少量锌粉的目的是_________________________________ 。
(3)步骤1加热可用____________ (填“水浴”、“油浴”或“直接加热”):从化学平衡的角度分析,控制分馏柱上端的温度在105℃左右的原因___________________ 。
(4)洗涤乙酰苯胺粗品最合适的方法是_______ (填序号)。
a.用少量冷水洗 b.用少量热水洗 c.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、_______ 、过滤、洗涤、干燥(选取正确的操作并排序)。
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品9.18g,则乙酰苯胺的产率是_____________ %(结果保留一位小数)
实验参数:
名称 | 相对分子质量 | 性状 | 密度g/cm3 | 沸点/。C | 溶解度 | |
苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |

实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30mL,冰醋酸15.4mL,锌粉0.100g,安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制。在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是
a. 25ml b. 50ml c. 150ml d. 200ml
(2)实验中加入少量锌粉的目的是
(3)步骤1加热可用
(4)洗涤乙酰苯胺粗品最合适的方法是
a.用少量冷水洗 b.用少量热水洗 c.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品9.18g,则乙酰苯胺的产率是
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙酰苯胺的制备原理为:
实验参数:
实验装置如图:

注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30 mL,冰醋酸15.4 mL,锌粉0.100 g, 安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105℃左右,反应约60~80 min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中物料以细流状倒入盛有100 mL冰水的烧杯中,剧烈搅拌,并冷却结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是_______ (填字母)。
a.25 mL b.50 mL c.150 mL d.200 mL
(2)实验中加入少量锌粉的目的是_______ 。
(3)步骤1加热可用_______ (填“水浴”“油浴”或“直接加热”)。从化学平衡的角度分析,控制分馏柱上端的温度在105℃左右的原因是_______ 。
(4)步骤2中结晶时,若冷却后仍无晶体析出,可采用的方法是_______ 。洗涤乙酰苯胺粗品最合适的试剂是_______ (填字母)。
a.用少量冷水洗 b.用少量热水洗 c.先用冷水洗,再用热水洗 d.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、_______ 、过滤、洗涤、干燥(选取正确的操作并排序)。
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品9.18 g,则乙酰苯胺的产率是_______ %(结果保留一位小数)。
实验参数:
| 名称 | 苯胺 | 乙酸 | 乙酰苯胺 |
| 式量 | 93 | 60 | 135 |
| 性状 | 无色油状液体,具有还原性 | 无色液体 | 白色晶体 |
| 密度/(g·cm-3) | 1.02 | 1.05 | 1.22 |
| 沸点/℃ | 184.4 | 118.1 | 304 |
| 溶解度 | 微溶于水 | 易溶于水 | 微溶于冷水,溶于热水 |
| 易溶于乙醇、乙醚等 | 易溶于乙醇、乙醚 | 易溶于乙醇、乙醚 |

注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30 mL,冰醋酸15.4 mL,锌粉0.100 g, 安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105℃左右,反应约60~80 min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中物料以细流状倒入盛有100 mL冰水的烧杯中,剧烈搅拌,并冷却结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是
a.25 mL b.50 mL c.150 mL d.200 mL
(2)实验中加入少量锌粉的目的是
(3)步骤1加热可用
(4)步骤2中结晶时,若冷却后仍无晶体析出,可采用的方法是
a.用少量冷水洗 b.用少量热水洗 c.先用冷水洗,再用热水洗 d.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品9.18 g,则乙酰苯胺的产率是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


