解答题-原理综合题 适中0.65 引用1 组卷21
研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1) 俗称“笑气”,曾用作麻醉剂。一定温度下
俗称“笑气”,曾用作麻醉剂。一定温度下 在某催化剂(cat)表面分解生成
在某催化剂(cat)表面分解生成 和
和 ,
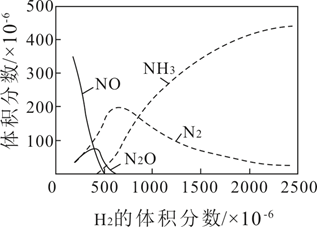
, 与催化剂面积、时间的关系如图所示:
与催化剂面积、时间的关系如图所示:
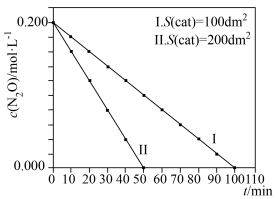
①根据直线Ⅰ、Ⅱ可得出的结论是,其他条件相同时,___________ 。
②在Ⅱ条件下,50min内 平均分解速率为
平均分解速率为___________ 。
③若 起始浓度
起始浓度 为0.400mol⋅L-1,比较不同起始浓度时
为0.400mol⋅L-1,比较不同起始浓度时 的平均分解速率:v(
的平均分解速率:v( mol⋅L-1)
mol⋅L-1)___________ v( mol⋅L-1)。(填“>”“=”或“<”)
mol⋅L-1)。(填“>”“=”或“<”)
(2)在 (Ⅲ)铁原子簇表面,反应
(Ⅲ)铁原子簇表面,反应
 的反应机理如下:
的反应机理如下:
ⅰ.

ⅱ.

ⅲ.

ⅳ.

①
___________ O(填“>”或“<”)。
②该机理中,速率控制步骤为___________ ,理由是___________ 。
(3)利用 的还原性可以消除氮氧化物的污染,反应原理之一为
的还原性可以消除氮氧化物的污染,反应原理之一为

 kJ⋅mol-1,当该反应转移3mol电子时,应放出热量
kJ⋅mol-1,当该反应转移3mol电子时,应放出热量___________ kJ;已知该反应的 kJ⋅mol-1⋅K-1,试通过计算说明该反应常温下(298K)能否自发?
kJ⋅mol-1⋅K-1,试通过计算说明该反应常温下(298K)能否自发?___________ 。
(1)

①根据直线Ⅰ、Ⅱ可得出的结论是,其他条件相同时,
②在Ⅱ条件下,50min内
③若
(2)在
ⅰ.
ⅱ.
ⅲ.
ⅳ.
①
②该机理中,速率控制步骤为
(3)利用
23-24高二上·安徽滁州·期中
类题推荐
甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol
写出表示甲醇CH3OH(l)燃烧热的热化学方程式___________ 。
(2)甲醇可采用煤的气化、液化制取(CO+2H2 CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与
CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 的关系如图所示。
的关系如图所示。
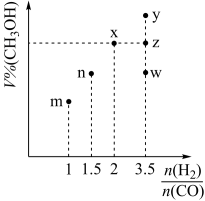
①当起始 =2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为
=2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为___________ ;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是___________ (填标号)
A.33% B.30% C.25% D.20%
②当 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“y”、“z”或“w”)。
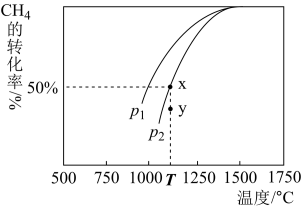
(3)制甲醇的CO和H2可用天然气来制取: 。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH___________ 0.(选填>、<或=,下同).当压强为p2时,在y点:V(正)___________ V(逆)。若p2=1.2Mpa,则T℃时该反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为 [反应Ⅰ]。
[反应Ⅰ]。
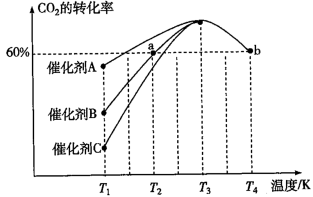
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最低的反应所用的催化剂是___________ (填“A”、“B”或“C”)。
②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应 [反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是________ 。
(1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+
③CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol
写出表示甲醇CH3OH(l)燃烧热的热化学方程式
(2)甲醇可采用煤的气化、液化制取(CO+2H2

①当起始
A.33% B.30% C.25% D.20%
②当
(3)制甲醇的CO和H2可用天然气来制取:

(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最低的反应所用的催化剂是

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应
| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网